题目内容
2.已知铜在常温下能被稀HNO3溶解,(1)反应方程式为3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O.
(2)请将上述反应改成离子方程式3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
(3)上述反应中,氧化剂是HNO3,氧化产物是Cu(NO3)2.
(4)氧化剂与还原剂的物质的量之比是2:3.
(5)每2molCu参加反应,转移的电子2.408×1024个,在反应的硝酸中没有参加氧化还原反应的硝酸占总硝酸的75%.
分析 Cu+4HN03==Cu(N03)2+2NO2↑+2H20中,Cu元素的化合价由 0升高为+2价,N元素的化合价由+5价降低为+4价,该反应中转移2mol电子,根据物质所含元素的化合价的变化判断氧化剂、还原产物以及参加氧化还原反应的硝酸的物质的量.
解答 解:(1)稀硝酸具有强氧化性,可与铜发生氧化还原反应,反应的化学方程式为3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O;
(2)反应的离子方程式为:3Cu+8H+十2NO3--═3Cu2++2NO↑十4H2O;
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)反应物HNO3中N元素的化合价由+5价降低为+2价,则HNO3为氧化剂,铜元素化合价升高,铜为还原剂,硝酸铜为氧化产物;
故答案为:HNO3;Cu(NO3)2;
(4)在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中,有8mol硝酸参加反应,只有2mol硝酸做氧化剂,氧化3mol铜,则氧化剂与还原剂的物质的量之比是 2:3,
故答案为:2:3;
(5)Cu元素的化合价由 0升高为+2价,每2molCu参加反应,转移的电子4mol,个数为2.408×1024,有8mol硝酸参加反应,只有2mol硝酸做氧化剂,在反应的硝酸中没有参加氧化还原反应的硝酸占总硝酸的75%,
故答案为:2.408×1024;75%.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子转移及计算的考查,注意硝酸在反应中的两个作用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17. 瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,下列有关说法正确的是( )
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,下列有关说法正确的是( )
 瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,下列有关说法正确的是( )
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,下列有关说法正确的是( )| A. | 电池工作时,Na+向电极1移动 | |
| B. | 电池工作一段时间后停止,溶液PH值比开始时明显减小 | |
| C. | 电极1发生的电极反应为2NH3+6OH--6e-═N2↑+6H2O | |
| D. | 用该电池做电源电解精炼铜,理论上每消耗0.2 mol NH3的同时阳极会得到19.2g纯铜 |
14.下列相关实验不能达到预期目的是( )
| 相关实验 | 预期目的 | |
| ① | 将Fe投入硫酸铜溶液中; | 验证Fe的金属性比Cu强. |
| ② | 将氯水加入淀粉KI溶液中 | 验证Cl的非金属性比I强 |
| ③ | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率. | 比较同周期金属元素的金属性强弱. |
| ④ | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
| A. | 仅④ | B. | ①④ | C. | ②③ | D. | ③④ |
11.元素周期表中碲元素的数据见下图,下列说法中正确的是( )


| A. | Te原子的相对原子质量是127.5 | |
| B. | Te元素可能会有多种同位素 | |
| C. | Te原子5p亚层有2对成对电子 | |
| D. | Te原子最外层有6个运动状态相同的电子 |
14.化学在生产和日常生活中有着重耍的应用,下列说法不正确的是( )
| A. | 明矾在水中形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 氧化铝常被用于制作作耐火材料 | |
| C. | Fe2O3俗称铁红,常用作红色的油漆和涂料 | |
| D. | Na2O2具有强氧化性,不能用作呼吸面具中的供氧剂 |
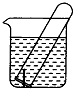 如图所示,水槽中试管内有一枚铁钉,放置数天观察:
如图所示,水槽中试管内有一枚铁钉,放置数天观察: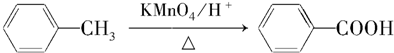

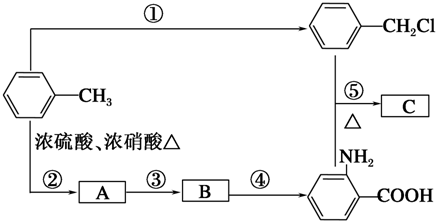
 、A物质的结构简式是
、A物质的结构简式是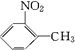 .
.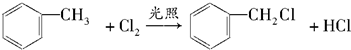 ,取代反应
,取代反应 ,取代反应.
,取代反应.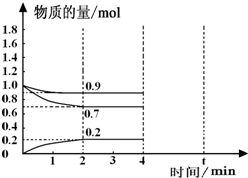 工业上合成合成氨的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
工业上合成合成氨的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol