题目内容
已知1-18号元素的离子aA3+、bB+、cC2-、dD-都具有相同的电子层结构,下列关系正确的是( )
| A、质子数c>b |
| B、离子的还原性C2->D- |
| C、氢化物的稳定性H2C>HD |
| D、离子半径A3+>B+ |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:短周期元素的离子:aA3+、bB+、cC2-、dD-都具有相同的电子层结构,则核外电子数相等,所以有:a-3=b-1=c+2=d+1,C、D为非金属,应处于第二周期,A、B为金属应处于第三周期,结合离子所带电荷,可知C为O元素,D为F元素,A为Al元素,B为Na元素,结合元素周期律解答.
解答:
解:短周期元素的离子:aA3+、bB+、cC2-、dD-都具有相同的电子层结构,则核外电子数相等,所以有:a-3=b-1=c+2=d+1,C、D为非金属,应处于第二周期,A、B为金属应处于第三周期,结合离子所带电荷,可知C为O元素,D为F元素,A为Al元素,B为Na元素,
A.B为Na元素,C为O元素,故b=11、c=8,则质子数:b>c,故A错误;
B.同周期随原子序数增大非金属性增强,故非金属性O<F,则离子还原性:O2->F-,故B正确;
C.同周期随原子序数增大非金属性增强,故非金属性O<F,非金属性越强氢化物越稳定,故氢化物稳定性:HF>H2O,故C错误;
D.电子层结构相同,核电荷数越大离子半径越小,故离子半径r(Al3+)<r(Na+),故D错误,
故选B.
A.B为Na元素,C为O元素,故b=11、c=8,则质子数:b>c,故A错误;
B.同周期随原子序数增大非金属性增强,故非金属性O<F,则离子还原性:O2->F-,故B正确;
C.同周期随原子序数增大非金属性增强,故非金属性O<F,非金属性越强氢化物越稳定,故氢化物稳定性:HF>H2O,故C错误;
D.电子层结构相同,核电荷数越大离子半径越小,故离子半径r(Al3+)<r(Na+),故D错误,
故选B.
点评:本题考查结构与位置关系、元素周期律等,难度中等,注意元素周期律的理解掌握,也可以根据电荷与核外电子排布相同推断元素在周期表中的位置而不需要推断具体的元素.

练习册系列答案
相关题目
下列各组液态混合物,能用分液漏斗进行分离的是( )
| A、CH3CH2OH和H2O |
| B、I2和CCl4 |
| C、H2O和植物油 |
| D、苯和甲苯 |
下列防止地下钢管锈蚀的措施中,不正确的是( )
| A、在钢管表面喷油漆 |
| B、使它与铜板相连 |
| C、使它与锌板相连 |
| D、使它与电源负极相连 |
下列说法中正确的是( )
| A、铝是地壳中含量最多的金属元素 |
| B、地球上的金属元素都是以化合态形式存在于自然界中 |
| C、所有金属都具有导电导热性,且在常温下都是固体 |
| D、金刚石是一种以金为主而构成的合金 |
 将一定量的Cl2通入一定浓度的烧碱溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
将一定量的Cl2通入一定浓度的烧碱溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )| A、烧碱溶液中NaOH的质量是3.6g |
| B、反应中转移电子的物质的量是0.09mol |
| C、氧化性ClO-<ClO3- |
| D、ClO3-的生成是由于温度升高引起的 |
下列有关说法正确的是( )
| A、CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B、将纯水加热至较高温度,水的离子积变大、pH变小、呈中性 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D、水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热过程 |
用下列气体和液体进行喷泉实验,最终液体不能充满烧瓶的是( )
| A、CO2和NaOH溶液 |
| B、SO2和NaOH溶液 |
| C、NO2和水 |
| D、氯化氢气体和水 |
在0.1mol?L-1 CH3COOH溶液中存在电离平衡CH3COOH?CH3COO-+H+,当加入下列物质时可使其电离程度和pH都减小的是( )
| A、CH3COONa浓溶液 |
| B、NH3?H2O |
| C、浓盐酸 |
| D、H2O |
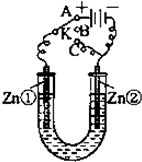 在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图所示:
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图所示: