题目内容
用下列气体和液体进行喷泉实验,最终液体不能充满烧瓶的是( )
| A、CO2和NaOH溶液 |
| B、SO2和NaOH溶液 |
| C、NO2和水 |
| D、氯化氢气体和水 |
考点:二氧化硫的化学性质,氮的氧化物的性质及其对环境的影响
专题:元素及其化合物
分析:进行喷泉实验,最终液体不能充满烧瓶,说明气体不能被溶液全部吸收,结合气体和溶液的性质判断.
解答:
解:A.如NaOH足量,二氧化碳可全部被吸收生成碳酸钠,故A不选;
B.如NaOH足量,SO2和NaOH溶液反应可生成亚硫酸钠,可充满烧瓶,故B不选.
C.二氧化氮与水反应生成硝酸和NO,NO不溶于水,不能充满烧瓶,故C选;
D.HCl极易溶于水,液体可充满烧瓶,故D不选;
故选C.
B.如NaOH足量,SO2和NaOH溶液反应可生成亚硫酸钠,可充满烧瓶,故B不选.
C.二氧化氮与水反应生成硝酸和NO,NO不溶于水,不能充满烧瓶,故C选;
D.HCl极易溶于水,液体可充满烧瓶,故D不选;
故选C.
点评:本题考查常见气体的性质以及喷泉实验,侧重于学生的实验能力和元素化合物知识的综合运用,难度不大,注意相关基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
NA代表阿伏加德罗常数的数值,下列叙述正确的是( )
| A、在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,转移4NA个电子 |
| B、1.0L 1.0mol/L NaAlO2水溶液中含有的氧原子数为2NA |
| C、标准状况下分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| D、假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶粒微粒数为NA |
下列分子中存在π键的是( )
| A、H2O |
| B、CH4 |
| C、NH3 |
| D、CO2 |
已知1-18号元素的离子aA3+、bB+、cC2-、dD-都具有相同的电子层结构,下列关系正确的是( )
| A、质子数c>b |
| B、离子的还原性C2->D- |
| C、氢化物的稳定性H2C>HD |
| D、离子半径A3+>B+ |
 如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( )
如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( )| A、N、Z两种元素的离子半径相比前者较大 |
| B、M、N两种元素的气态氢化物的稳定性相比后者较强 |
| C、X与M两种元素组成的化合物能与水反应生成相应的酸 |
| D、工业上常用电解Y和N形成的化合物的熔融态制取Y的单质 |
T℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的 浓度变化如图(Ⅰ)所示.保持其它条件不变,在T1、T2两种温度下,Y的体积分数变化如图(Ⅱ)所示,下列结论正确的是( )
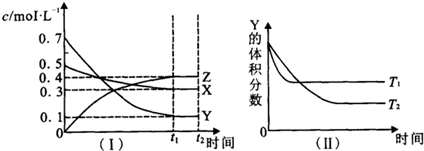

| A、图(Ⅱ)中T1>T2,则正反应是吸热反应 |
| B、t2 min时,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
| C、其它条件不变,升高温度,正、逆反应速率均增大,且X的转化率增大 |
| D、T℃时,若密闭容器中各物质起始浓度为:0.4mol?L-1 X、0.4mol?L-1 Y、0.2mol/L Z保持其他条件不变,达到平衡时z的浓度为0.4 mol?L-1 |
下列物质的分类合理的是( )
| A、酸:H2S、H2O、H2SO4、H2CO3 |
| B、碱:NaOH、KOH、Ba(OH)2、Cu2(OH)2CO3 |
| C、铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3?H2O |
| D、氧化物:CO2、NO、SO2、H2O |
