题目内容
下列有关说法正确的是( )
| A、CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B、将纯水加热至较高温度,水的离子积变大、pH变小、呈中性 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D、水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热过程 |
考点:反应热和焓变,化学平衡的影响因素,水的电离
专题:基本概念与基本理论
分析:A、根据△G=△H-T?△S<0自发判断;
B、水的电离过程为吸热反应,温度升高,水的电离程度增大,溶液中的氢离子、氢氧根离子浓度增大,但浓度仍然相等;
C、升高温度,化学反应速率增大,平衡向吸热的方向移动,即逆反应方向移动,反应物的转化率减少;
D、水的离子积常数Kw随着温度的升高而增大,说明升高温度平衡正向移动,正反应方向吸热.
B、水的电离过程为吸热反应,温度升高,水的电离程度增大,溶液中的氢离子、氢氧根离子浓度增大,但浓度仍然相等;
C、升高温度,化学反应速率增大,平衡向吸热的方向移动,即逆反应方向移动,反应物的转化率减少;
D、水的离子积常数Kw随着温度的升高而增大,说明升高温度平衡正向移动,正反应方向吸热.
解答:
解:A、CaCO3(s)=CaO(s)+CO2(g),固体分解得到气体,混乱度增加,△S>0,室温下不能自发进行即△G=△H-T?△S>0,说明该反应的△H>0,故A错误;
B、将纯水加热至较高温度,溶液中的氢离子、氢氧根离子浓度增大,但浓度仍然相等,水的离子积变大、pH变小、呈中性,故B正确;
C、N2(g)+3H2(g)?2NH3(g)△H<0为放热反应,升高温度,化学反应速率增大,平衡向逆反应方向移动,所以反应速率v(H2)增大,H2的平衡转化率减小,故C错误;
D、水的离子积常数Kw随着温度的升高而增大,说明升高温度平衡正向移动,正反应方向吸热,即水的电离是吸热过程,故D错误;
故选B.
B、将纯水加热至较高温度,溶液中的氢离子、氢氧根离子浓度增大,但浓度仍然相等,水的离子积变大、pH变小、呈中性,故B正确;
C、N2(g)+3H2(g)?2NH3(g)△H<0为放热反应,升高温度,化学反应速率增大,平衡向逆反应方向移动,所以反应速率v(H2)增大,H2的平衡转化率减小,故C错误;
D、水的离子积常数Kw随着温度的升高而增大,说明升高温度平衡正向移动,正反应方向吸热,即水的电离是吸热过程,故D错误;
故选B.
点评:本题考查化学反应进行的方向,外界条件对化学平衡的影响,注重基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验室制备气体的说法正确的是( )
| A、制备氯气,可以用MnO2与稀盐酸反应 |
| B、制备氨气,可以用浓硫酸干燥 |
| C、制备HI,可以用浓硫酸与NaI反应 |
| D、制备SO2,可以用NaOH溶液进行尾气吸收 |
关于物质的用途说法错误的是( )
| A、甲烷是家用天然气的主要成分 |
| B、氯气可用于制取漂白粉 |
| C、晶体硅是制造光导纤维的主要原料 |
| D、碳酸氢钠可作发酵剂 |
已知1-18号元素的离子aA3+、bB+、cC2-、dD-都具有相同的电子层结构,下列关系正确的是( )
| A、质子数c>b |
| B、离子的还原性C2->D- |
| C、氢化物的稳定性H2C>HD |
| D、离子半径A3+>B+ |
蒸馏分离时,会导致收集到的产品中混有高沸点杂质的图示是( )
A、 |
B、 |
C、 |
D、 |
T℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的 浓度变化如图(Ⅰ)所示.保持其它条件不变,在T1、T2两种温度下,Y的体积分数变化如图(Ⅱ)所示,下列结论正确的是( )
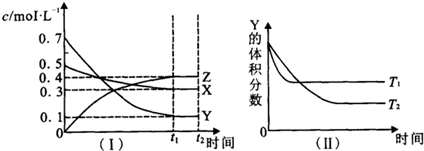

| A、图(Ⅱ)中T1>T2,则正反应是吸热反应 |
| B、t2 min时,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
| C、其它条件不变,升高温度,正、逆反应速率均增大,且X的转化率增大 |
| D、T℃时,若密闭容器中各物质起始浓度为:0.4mol?L-1 X、0.4mol?L-1 Y、0.2mol/L Z保持其他条件不变,达到平衡时z的浓度为0.4 mol?L-1 |
蒸干下列物质可以得到溶质本身的是( )
| A、AlCl3溶液 |
| B、NaHCO3溶液 |
| C、Fe2(SO4)3溶液 |
| D、CuCl2溶液 |