题目内容
在0.1mol?L-1 CH3COOH溶液中存在电离平衡CH3COOH?CH3COO-+H+,当加入下列物质时可使其电离程度和pH都减小的是( )
| A、CH3COONa浓溶液 |
| B、NH3?H2O |
| C、浓盐酸 |
| D、H2O |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.加入醋酸钠溶液,醋酸根离子浓度增大抑制醋酸电离;
B.加入一水合氨,氢离子和一水合氨反应生成水和铵根离子,促进醋酸电离;
C.加入浓盐酸,氢离子浓度在抑制醋酸电离;
D.加水稀释促进醋酸电离.
B.加入一水合氨,氢离子和一水合氨反应生成水和铵根离子,促进醋酸电离;
C.加入浓盐酸,氢离子浓度在抑制醋酸电离;
D.加水稀释促进醋酸电离.
解答:
解:A.加入醋酸钠溶液,醋酸根离子浓度增大抑制醋酸电离,溶液中氢离子浓度减小,pH增大,故A错误;
B.加入一水合氨,氢离子和一水合氨反应生成水和铵根离子,促进醋酸电离,氢离子浓度减小,溶液的pH减小,故B错误;
C.加入浓盐酸,氢离子浓度在抑制醋酸电离,但溶液中氢离子浓度增大,则醋酸的电离程度及pH都减小,故C正确;
D.加水稀释促进醋酸电离,溶液中氢离子浓度减小,则醋酸电离程度及pH都增大,故D错误;
故选C.
B.加入一水合氨,氢离子和一水合氨反应生成水和铵根离子,促进醋酸电离,氢离子浓度减小,溶液的pH减小,故B错误;
C.加入浓盐酸,氢离子浓度在抑制醋酸电离,但溶液中氢离子浓度增大,则醋酸的电离程度及pH都减小,故C正确;
D.加水稀释促进醋酸电离,溶液中氢离子浓度减小,则醋酸电离程度及pH都增大,故D错误;
故选C.
点评:本题考查了弱电解质的电离,根据影响弱电解质电离因素分析解答,注意稀释醋酸时溶液中氢离子浓度减小但氢氧根离子浓度增大,为易错点.

练习册系列答案
相关题目
已知1-18号元素的离子aA3+、bB+、cC2-、dD-都具有相同的电子层结构,下列关系正确的是( )
| A、质子数c>b |
| B、离子的还原性C2->D- |
| C、氢化物的稳定性H2C>HD |
| D、离子半径A3+>B+ |
T℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的 浓度变化如图(Ⅰ)所示.保持其它条件不变,在T1、T2两种温度下,Y的体积分数变化如图(Ⅱ)所示,下列结论正确的是( )
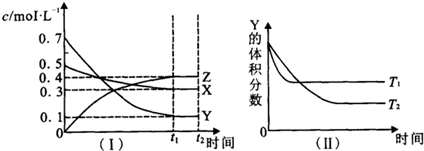

| A、图(Ⅱ)中T1>T2,则正反应是吸热反应 |
| B、t2 min时,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
| C、其它条件不变,升高温度,正、逆反应速率均增大,且X的转化率增大 |
| D、T℃时,若密闭容器中各物质起始浓度为:0.4mol?L-1 X、0.4mol?L-1 Y、0.2mol/L Z保持其他条件不变,达到平衡时z的浓度为0.4 mol?L-1 |
蒸干下列物质可以得到溶质本身的是( )
| A、AlCl3溶液 |
| B、NaHCO3溶液 |
| C、Fe2(SO4)3溶液 |
| D、CuCl2溶液 |
下列物质的分类合理的是( )
| A、酸:H2S、H2O、H2SO4、H2CO3 |
| B、碱:NaOH、KOH、Ba(OH)2、Cu2(OH)2CO3 |
| C、铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3?H2O |
| D、氧化物:CO2、NO、SO2、H2O |
分类法是学习和研究化学的一种常用的科学方法.下列分类合理的是( )
| A、根据分子中含有的氢原子的个数将酸分为一元酸、二元酸等 |
| B、根据反应中的能量变化,将化学反应分为:“化合,分解,置换,复分解”四类 |
| C、根据溶液导电能力的强弱,将电解质分为强电解质和弱电解质 |
| D、KOH和NH3?H2O都是碱 |