题目内容
8.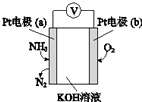 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理(如图)与原电池的工作原理类似.
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理(如图)与原电池的工作原理类似.(1)b为正极,发生还原反应(填“氧化”或“还原”);
(2)溶液中的OH-向a极移动(填“a”或“b”);
(3)负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
分析 Pt电子通入氨气生成氮气,说明氨气被氧化,为原电池负极,则b为正极,氧气得电子被还原,结合电极方程式解答该题.
解答 解:Pt电子通入氨气生成氮气,说明氨气被氧化,为原电池负极,则b为正极,氧气得电子被还原,
(1)氧气在b极发生还原反应,则b极为正极,发生还原反应,故答案为:还原;
(2)a极为负极,溶液中的阴离子向负极移动,故答案为:a;
(3)负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O,故答案为:2NH3-6e-+6OH-=N2+6H2O.
点评 本题考查了原电池原理,根据O、N元素化合价变化判断正负极,再结合反应物、生成物及得失电子书写电极反应式,注意书写电极反应式时要结合电解质特点,为易错点.

练习册系列答案
相关题目
18.下列各组反应(表中物质均为反应物),在反应刚开始时,放出H2的速率最大的是( )
| 金属(粉末状)mol | 酸的浓度及体积 | 反应温度 | |
| A | Zn 0.1 | 6mol/L硝酸 10mL | 70℃ |
| B | Zn 0.1 | 3mol/L硫酸 10mL | 70℃ |
| C | Fe 0.1 | 3mol/L盐酸 10mL | 60℃ |
| D | Zn 0.1 | 3mol/L盐酸 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
19.在无色透明溶液中,能大量共存的离子组是( )
| A. | Cu2+、Na+、SO42-、NO3- | B. | K+、Na+、HCO3-、NO3- | ||
| C. | OH-、HCO3-、Ba2+、Na+ | D. | H+、Fe2+、NO3-、Cl- |
3.我国科学家成功地研制出长期依赖进口、价格昂贵的物质${\;}_{8}^{18}$O2.下列说法正确的是( )
| A. | 它是一种新元素 | |
| B. | 它和O3互为同素异形体 | |
| C. | ${\;}_{8}^{18}$O2与${\;}_{2}^{16}$O2互为同位素 | |
| D. | 1mol ${\;}_{8}^{18}$O2分子中含有20mol电子 |
13.满足分子式为C4H8ClBr的有机物共有( )
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
20.下列叙述中,正确的是( )
| A. | P4和CO2中只含有共价键 | |
| B. | CCl4和NH3的立体构型都是正四面体 | |
| C. | BF3中各原子均达到8电子的稳定结构 | |
| D. | 甲烷是对称的平面形结构 |
17.下列说法正确的是( )
| A. | 12C和C60属于同一种元素,互为同素异形体 | |
| B. | 16O和18O是不同的核素,互为同位素 | |
| C. | 37Cl和35Cl可以通过化学变化实现相互转化 | |
| D. | H2O和H2O2由同种元素组成,二者互为同素异形体 |
18.已知:某条件下CH3CHO(1)→CH4+CO,反应的活化能为190kJ•mol-1.在含有少量I2的溶液中,该反应的机理为:
CO3CHO+I2→CH3I+HI+CO(慢)
CH3I+HI→CH4+I2(快)
下列有关该反应的叙述中正确的是( )
CO3CHO+I2→CH3I+HI+CO(慢)
CH3I+HI→CH4+I2(快)
下列有关该反应的叙述中正确的是( )
| A. | 反应速率与I2的浓度有关 | |
| B. | HI也是该反应的催化剂 | |
| C. | 反应焓变的绝对值等于190kJ•mol-1 | |
| D. | v(CH4)>v(CH3CHO)=v(CO) |
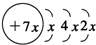 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了泡利原理和洪特规则.
,这样排布遵循了泡利原理和洪特规则. .
.