题目内容
16.A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: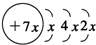 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:(1)写出下列元素的符号:ASi BNa CP DN
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是HNO3,碱性最强的是NaOH.
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是F,电负性最大的元素是F.
(4)D的氢化物比C的氢化物的沸点高(填“高“或“低“),原因NH3分子间形成氢键
(5)E元素原子的核电荷数是_26,E元素在周期表的第四周期,第Ⅷ族,已知元素周期表可按电子排布分为s区、p区等,则E元素在d区.
(6)画出D的核外电子排布图
 ,这样排布遵循了泡利原理和洪特规则.
,这样排布遵循了泡利原理和洪特规则.(7)用电子式表示B的硫化物的形成过程:
 .
.
分析 A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素.
解答 解:A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,则E为Fe元素.
(1)由上述分析可知,A为Si、B为Na、C为P、D为N,
故答案为:Si;Na;P;N;
(2)上述五种元素中,N的非金属性最强,Na的金属性最强,故HNO3的酸性最强,NaOH的碱性最强,
故答案为:HNO3;NaOH;
(3)同周期自左而右,第一电离能呈增大趋势(个别除外),所以第一电离能最大的元素是F,周期自左而右,电负性增大,故电负性最大的元素是F,
故答案为:F;F;
(4)D的氢化物NH3、C的氢化物为PH3,因为NH3分子间能形成氢键,使NH3的沸点高于PH3的,
故答案为:高;NH3分子间形成氢键;
(5)E为Fe元素,E的核外电子排布式为1s22s22p63s23p63d64s2,故核电荷数是26,Fe在周期表中处于第四周期第Ⅷ族,在周期表中处于d 区,
故答案为:26;四、Ⅷ;d;
(6)D是N元素,原子核外有7个电子,1s、2s、2p能级上分别排列2、2、3个电子,所以其核外电子排布图为: ,这样排布遵循了泡利不相容原理、洪特规则,
,这样排布遵循了泡利不相容原理、洪特规则,
故答案为: ;泡利;洪特;
;泡利;洪特;
(7)B的硫化物为Na2S,用电子式表示形成过程: ,
,
故答案为: .
.
点评 本题结构性质位置关系应用,涉及元素周期律、核外电子排布规律、氢键、常用化学用语等,推断元素是解题的关键,注意同周期第一电离能异常情况.

 优学名师名题系列答案
优学名师名题系列答案| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 相同条件下,pH=5的①NH4C1溶液、②CH3C00H溶液、③稀盐酸溶液中由水电离出的c(H+):①>②>③ | |
| C. | 体积相同、浓度均为0.1mol/L的盐酸和醋酸,分别稀释m倍、n倍,溶液的pH都变成5,则m<n | |
| D. | pH=5的硫酸溶液稀释到原来的500倍,稀释后溶液中的c(SO42-)与c(H+)之比约为1:10 |
| A. | Na、Mg、Al的还原性依次减弱 | B. | I、Br、Cl的非金属性性依次增强 | ||
| C. | C、N、O 的原子半径依次增大 | D. | P、S、Cl的最高正化合价依次升高 |
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
| A. | 原子半径 | B. | 元素的主要化合价 | ||
| C. | 相对原子质量 | D. | 金属性和非金属性 |
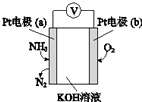 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理(如图)与原电池的工作原理类似.
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理(如图)与原电池的工作原理类似.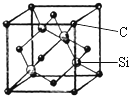 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答: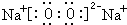 .X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是(用化学式表示)H2O2.
.X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是(用化学式表示)H2O2.