题目内容
20.下列叙述中,正确的是( )| A. | P4和CO2中只含有共价键 | |
| B. | CCl4和NH3的立体构型都是正四面体 | |
| C. | BF3中各原子均达到8电子的稳定结构 | |
| D. | 甲烷是对称的平面形结构 |
分析 A.一般的活泼金属和活泼非金属元素之间存在离子键,非金属元素之间存在共价键;
B.P4分子构型为正四面体,NH3为三角锥型;
C.对于ABn型共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构;
D.甲烷是对称的正四面体结构.
解答 解:A.非金属原子之间形成共价键,白磷的分子的结构为 ,只含有P-P共价键,二氧化碳分子结构简式为O=C=O,分子中碳原子和氧原子之间存在共价键,故A正确;
,只含有P-P共价键,二氧化碳分子结构简式为O=C=O,分子中碳原子和氧原子之间存在共价键,故A正确;
B.P4 为分子晶体,其分子结构为 ,为正四面体结构,氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,所以氮原子杂化方式是sp3,因为含有一个孤电子对,所以是三角锥型结构,故B错误;
,为正四面体结构,氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,所以氮原子杂化方式是sp3,因为含有一个孤电子对,所以是三角锥型结构,故B错误;
C.BF3中B为3+3=6,F为1+7=8,B原子未达到8电子的稳定结构,故C错误;
D.CH4中中心原子价层电子对个数为4,4个共价键完全相同,碳原子采用sp3杂化,则其分子结构为四面体结构,故D错误;
故选A.
点评 本题考查了化学键与空间构型的判断,注意把握价层电子对互斥理论的应用,注意理解熟记常见分子的空间构型,题目难度中等.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
15.下列与含氯物质有关的说法正确的是( )
| A. | 氯水要现用现制,并保存在盖有橡胶塞的棕色瓶子中,置于冷暗处 | |
| B. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| C. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| D. | 电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数) |
9.元素周期表是元素周期律的反映,元素在周期表中的位置、元素的原子结构和元素的性质存在密切关系.
(1)如表是部分边线未画出的周期表,表中的序号分别代表某一化学元素.根据表中所列元素,回答下列有关问题:
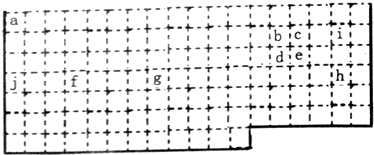
①常温下单质为液体的化学式是Br2;最高价氧化物对应水化物碱性最强的元素符号是K;其氧化物为光导纤维重要材料的元素名称是硅;e元素原子的最外层电子数为5.
②上述元素中属于过渡元素的有fg(填序号);元素周期表中的主、副族序数与周期表的列数有一定关系,f元素在周期表中的位置为第四周期ⅣB族.
③第二周期中,最高正价和主族序数相等的元素符号为C、N,元素最高价氧化物的水化物和其氢化物能发生化合反应,化学方程式为NH3+HNO3=NH4NO3.
(2)部分元素的原子结构特点如表:
①W2+的结构示意图 .
.
②等质量单质M分别与过量的强酸和强碱反应,生成H2的物质的量之比为1:1.
③能说明X单质的氧化性比Z单质的氧化性强的化学方程式为O2+2H2S=2S↓+2H2O.
④z形成的两核18电子微粒与X形成的两核10电子微粒反应生成另外18电子和10电子两种微粒的离子方程式为HS-+OH-=S2-+H2O.
(1)如表是部分边线未画出的周期表,表中的序号分别代表某一化学元素.根据表中所列元素,回答下列有关问题:

①常温下单质为液体的化学式是Br2;最高价氧化物对应水化物碱性最强的元素符号是K;其氧化物为光导纤维重要材料的元素名称是硅;e元素原子的最外层电子数为5.
②上述元素中属于过渡元素的有fg(填序号);元素周期表中的主、副族序数与周期表的列数有一定关系,f元素在周期表中的位置为第四周期ⅣB族.
③第二周期中,最高正价和主族序数相等的元素符号为C、N,元素最高价氧化物的水化物和其氢化物能发生化合反应,化学方程式为NH3+HNO3=NH4NO3.
(2)部分元素的原子结构特点如表:
| 元素 | 相关信息 |
| X | 第二层的电子数是第一层电子数的3倍 |
| Y | 元素的原子中没有中子 |
| Z | 第二层电子数是第一层和第三层电子数之和 |
| X、W、M | X2-、W2+、M3+具有相同的电子层结构 |
 .
.②等质量单质M分别与过量的强酸和强碱反应,生成H2的物质的量之比为1:1.
③能说明X单质的氧化性比Z单质的氧化性强的化学方程式为O2+2H2S=2S↓+2H2O.
④z形成的两核18电子微粒与X形成的两核10电子微粒反应生成另外18电子和10电子两种微粒的离子方程式为HS-+OH-=S2-+H2O.

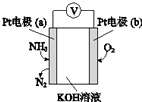 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理(如图)与原电池的工作原理类似.
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理(如图)与原电池的工作原理类似. 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答: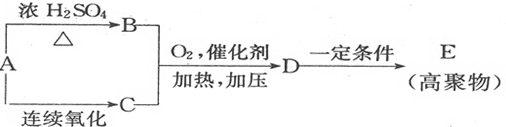
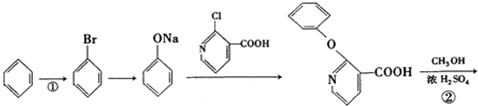

 +H2N-NH2→
+H2N-NH2→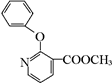 +CH3OH,
+CH3OH, ,
,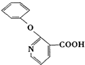 的分子式为C12H9O3N,它有多种同分异构体,其中符合下列条件的同分异构体共有4种.
的分子式为C12H9O3N,它有多种同分异构体,其中符合下列条件的同分异构体共有4种.