题目内容
18.已知:某条件下CH3CHO(1)→CH4+CO,反应的活化能为190kJ•mol-1.在含有少量I2的溶液中,该反应的机理为:CO3CHO+I2→CH3I+HI+CO(慢)
CH3I+HI→CH4+I2(快)
下列有关该反应的叙述中正确的是( )
| A. | 反应速率与I2的浓度有关 | |
| B. | HI也是该反应的催化剂 | |
| C. | 反应焓变的绝对值等于190kJ•mol-1 | |
| D. | v(CH4)>v(CH3CHO)=v(CO) |
分析 由反应Ⅰ、Ⅱ可知反应中碘为催化剂,总反应的快慢取决于反应较慢的反应,结合化合价的变化解答该题.
解答 解:A.碘为催化剂,增大反应速率,浓度越大,反应速率越大,故A正确;
B.反应I中碘元素化合价降低,HI为还原产物,不是催化剂,故B错误;
C.焓变为反应物与生成物的活化能之差,故C错误;
D.反应I较慢,决定着总反应的快慢,故D错误.
故选A.
点评 本题考查化学反应机理,为高频考点,侧重于学生的分析能力的考查,注意把握题给信息以及反应的原理,难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
9.元素周期表是元素周期律的反映,元素在周期表中的位置、元素的原子结构和元素的性质存在密切关系.
(1)如表是部分边线未画出的周期表,表中的序号分别代表某一化学元素.根据表中所列元素,回答下列有关问题:
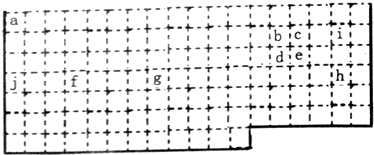
①常温下单质为液体的化学式是Br2;最高价氧化物对应水化物碱性最强的元素符号是K;其氧化物为光导纤维重要材料的元素名称是硅;e元素原子的最外层电子数为5.
②上述元素中属于过渡元素的有fg(填序号);元素周期表中的主、副族序数与周期表的列数有一定关系,f元素在周期表中的位置为第四周期ⅣB族.
③第二周期中,最高正价和主族序数相等的元素符号为C、N,元素最高价氧化物的水化物和其氢化物能发生化合反应,化学方程式为NH3+HNO3=NH4NO3.
(2)部分元素的原子结构特点如表:
①W2+的结构示意图 .
.
②等质量单质M分别与过量的强酸和强碱反应,生成H2的物质的量之比为1:1.
③能说明X单质的氧化性比Z单质的氧化性强的化学方程式为O2+2H2S=2S↓+2H2O.
④z形成的两核18电子微粒与X形成的两核10电子微粒反应生成另外18电子和10电子两种微粒的离子方程式为HS-+OH-=S2-+H2O.
(1)如表是部分边线未画出的周期表,表中的序号分别代表某一化学元素.根据表中所列元素,回答下列有关问题:

①常温下单质为液体的化学式是Br2;最高价氧化物对应水化物碱性最强的元素符号是K;其氧化物为光导纤维重要材料的元素名称是硅;e元素原子的最外层电子数为5.
②上述元素中属于过渡元素的有fg(填序号);元素周期表中的主、副族序数与周期表的列数有一定关系,f元素在周期表中的位置为第四周期ⅣB族.
③第二周期中,最高正价和主族序数相等的元素符号为C、N,元素最高价氧化物的水化物和其氢化物能发生化合反应,化学方程式为NH3+HNO3=NH4NO3.
(2)部分元素的原子结构特点如表:
| 元素 | 相关信息 |
| X | 第二层的电子数是第一层电子数的3倍 |
| Y | 元素的原子中没有中子 |
| Z | 第二层电子数是第一层和第三层电子数之和 |
| X、W、M | X2-、W2+、M3+具有相同的电子层结构 |
 .
.②等质量单质M分别与过量的强酸和强碱反应,生成H2的物质的量之比为1:1.
③能说明X单质的氧化性比Z单质的氧化性强的化学方程式为O2+2H2S=2S↓+2H2O.
④z形成的两核18电子微粒与X形成的两核10电子微粒反应生成另外18电子和10电子两种微粒的离子方程式为HS-+OH-=S2-+H2O.
13.下列说法正确的是( )
| A. | 可以用福尔马林(35%-40%的甲醛水溶液)浸泡海产品进行防腐保鲜 | |
| B. | 油脂是一种高分子化合物,工业上可以用它为原料制肥皂 | |
| C. | 屠呦呦在青蒿素的发现过程中起了关键作用,她也因此获2015年度诺贝尔化学奖 | |
| D. | 铁是人体健康、植物生长所必须的元素之一,缺铁时可用补充FeSO4的方法补铁 |
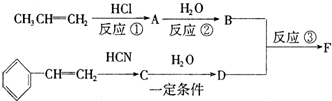
3.有关如图所示化合物的说法正确的是( )


| A. | 该物质的化学式是C23H24O6 | |
| B. | 1mol该化合物最多可以与9molH2加成 | |
| C. | 酸性KMnO4溶液、溴水能与该物质发生氧化还原反应而褪色 | |
| D. | 该物质与FeCl3溶液作用可显红色,该反应可用于检验其中的酚羟基 |
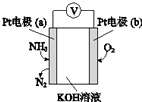 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理(如图)与原电池的工作原理类似.
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理(如图)与原电池的工作原理类似.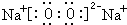 .X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是(用化学式表示)H2O2.
.X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是(用化学式表示)H2O2.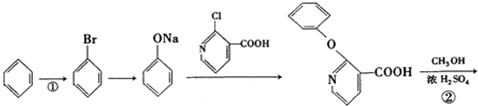

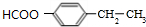
 +H2N-NH2→
+H2N-NH2→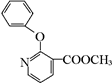 +CH3OH,
+CH3OH, ,
,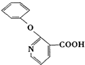 的分子式为C12H9O3N,它有多种同分异构体,其中符合下列条件的同分异构体共有4种.
的分子式为C12H9O3N,它有多种同分异构体,其中符合下列条件的同分异构体共有4种.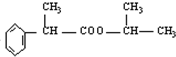
 .
. .
.


