题目内容
7.已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s);△H1=571.2kJ/mol,BaSO4(s)+2C(s)=2CO2(g)+BaS(s);△H2=226.2kJ/mol.
则反应C(s)+CO2(g)=2CO(g)的△H3=172.5 kJ/mol.
分析 已知:①BaSO4(s)+4C(s)=4CO(g)+BaS(s);△H1=571.2kJ/mol,
②BaSO4(s)+2C(s)=2CO2(g)+BaS(s);△H2=226.2kJ/mol
根据盖斯定律,将热化学方程式按照$\frac{1}{2}$(①-②)整理可得C(s)+CO2(g)=2CO(g),据此进行解答.
解答 解:①BaSO4(s)+4C(s)=4CO(g)+BaS(s);△H1=571.2kJ/mol
②BaSO4(s)+2C(s)=2CO2(g)+BaS(s);△H2=226.2kJ/mol
根据盖斯定律,将热化学方程式按照$\frac{1}{2}$(①-②)整理可得C(s)+CO2(g)=2CO(g),△H3=$\frac{1}{2}$(△H1-△H3)=$\frac{1}{2}$(571.2kJ/mol-226.2kJ/mol)=172.5kJ/mol,
故答案为:172.5.
点评 本题考查了盖斯定律在反应热计算中的应用,题目难度中等,明确盖斯定律的内容为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
8.在Na+的物质的量浓度为0.5mol•L-1的某澄清溶液中,还可能含有如表中所示的若干种离子.
取100mL该溶液进行如下实验(气体体积在标准状况下测定):
请回答下列问题:
(1)由实验Ⅰ确定一定不存在的离子是Ag+、Mg2+、Ba2+.
(2)实验Ⅰ中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓.
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写表中阴离子的物质的量浓度(能计算出结果的填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
(4)判断K+是否存在,若存在,求其最小浓度,若不存在,请说明理由:存在,其浓度至少为0.8mol/L.
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 想该溶液中加入足量稀盐酸 | 生成白色沉淀并在标准状况下放出0.56L气体 |
| Ⅱ | 将Ⅰ中产生的混合液过滤,将沉淀洗涤、灼烧至恒重,称量所得固体的质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ中所得的滤液中滴加BaCl2溶液 | 无明显现象 |
(1)由实验Ⅰ确定一定不存在的离子是Ag+、Mg2+、Ba2+.
(2)实验Ⅰ中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓.
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写表中阴离子的物质的量浓度(能计算出结果的填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol•L-1 | ? | 0.25mol/L | 0.4mol/L | 0 |
9.等物质的量的下列物质,与足量氢气发生加成反应,消耗氢气最多的是( )
| A. | CH2═CH-CH═CH2 | B. | 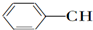 ═CH2 ═CH2 | C. | 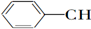 ═CH-CH2 ═CH-CH2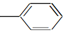 | D. | 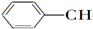 ═CH-CH═ ═CH-CH═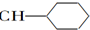 |
6.某炔烃与氢气加成后得到 ,该炔烃可能有的结构式有( )
,该炔烃可能有的结构式有( )
 ,该炔烃可能有的结构式有( )
,该炔烃可能有的结构式有( )| A. | 一种 | B. | 二种 | C. | 三种 | D. | 四种 |
2.有机物的种类繁多,但其命名是有规则的,下列有机物命名正确的是( )
| A. |  1,4-二甲基丁 1,4-二甲基丁 | B. | 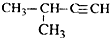 3-甲基丁炔 3-甲基丁炔 | C. | 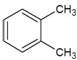 二甲基苯 二甲基苯 | D. | 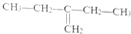 2-乙基-1-丁烯 2-乙基-1-丁烯 |
19.天津港“8•12”危化仓库爆炸,造成生命、财产重大损失,其爆炸品中有金属钠.运输金属钠的集装箱应贴有的警示标识是( )
| A. |  氧化剂 | B. |  爆炸品 | C. |  剧毒品 | D. |  遇湿易燃物品 |
16.下列关于平衡移动的说法不正确的是( )
| A. | 当正反应与逆反应速率相等时,平衡不移动 | |
| B. | 当正反应大于逆反应速率时,平衡向正反应方向移动 | |
| C. | 当正反应小于逆反应速率时,平衡向正反应方向移动 | |
| D. | 反应速率发生改变,平衡不一定发生移动 |
17.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1L 0.1mol/L的NaOH溶液中氧原子个数为0.1NA | |
| B. | 3g SiO2中Si-O数目为0.1NA | |
| C. | 0.1 mol钠与足量O2充分反应时,转移的电子数为0.1NA | |
| D. | 0.2 mol SO2与0.1mol O2充分反应,产物的分子数为0.1NA |
