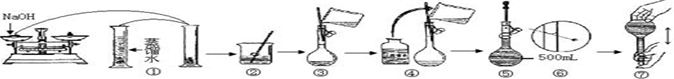
题目内容
4.已知在1×105Pa,298K 条件下,2mol 氢气燃烧生成水蒸气放出484kJ 热量,下列热化学方程式正确的是( )| A. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=242 kJ?mol-1 | B. | 2H2(g)+O2(g)=2H2O(g)△H=-484 kJ?mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H=-242 kJ?mol-1 | D. | 2H2(g)+O2(g)=2H2O(g)△H=+484 kJ?mol-1 |
分析 2mol氢气燃烧生成水蒸气放出484kJ热量,则1mol氢气燃烧生成水蒸气放出242kJ热量,其逆过程就要吸收这些热量,根据氢气燃烧生成水蒸气的逆过程为吸热过程来分析,注意物质的状态和计量数在变化时,焓变的符号和数值也相应倍数的改变.
解答 解:A.2mol氢气燃烧生成水蒸气放出484kJ热量,则1mol氢气燃烧生成水蒸气放出242kJ热量,其逆过程就要吸收这些热量,焓变应该为正值,正确的热化学方程式为:H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+242kJ•mol-1,故A错误;
B.在1×105Pa,298K 条件下,2mol 氢气燃烧生成水蒸气放出484kJ 热量,该反应的热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-484 kJ?mol-1,故B正确;
C.生成的水应该为气态(g),而不是液态(l),故C错误;
D.根据H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+242kJ•mol-1,逆反应为放热反应,此时焓变符号为负,数值与计量数成正比例关系,正确的热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-484 kJ•mol-1,故D错误;
故选B.
点评 本题考查热化学方程式的书写方法,为高考热点,题目难度不大,明确热化学方程式的书写原则为解答关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
15.如表,已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,常温下其氢化物中甲、乙、丙、丁、戊的化合价如下,下列说法正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 乙的常见氧化物有两种 | |
| B. | 气态氢化物稳定性:丙<丁 | |
| C. | 丙的氧化物能与戊的氢化物的水溶液反应 | |
| D. | 原子半径大小:甲>丙 |
14.化工生产需要用到各种原料,其中与事实相符合的是( )
| A. | 用乙醇和浓硫酸制乙烯 | B. | 用电解水获得的氢气来合成氨 | ||
| C. | 用晒盐后的卤水制溴单质 | D. | 用氢氧化钠和二氧化碳制碳酸钠 |
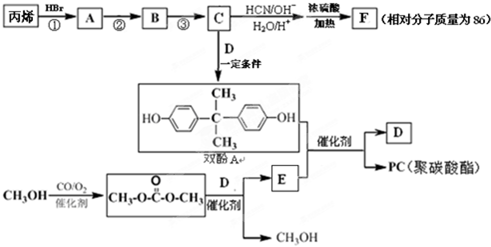
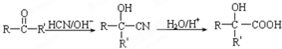
 (R、R′、R″代表羟基)
(R、R′、R″代表羟基) .
.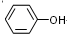 .
. .
.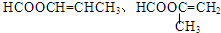 .
.