题目内容
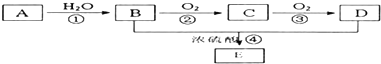
亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌.如图1是制取亚氯酸钠的工艺流程:
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用.②ClO2气体在中性和碱性溶液中不能稳定存在.
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式 .
(2)反应生成ClO2气体需要X酸酸化,X酸可以为 .
A.盐酸 B.稀硫酸 C.硝酸 D.H2C2O4溶液
(3)吸收塔内的温度不能过高的原因为 .
(4)ClO2被S2-还原为ClO2-、Cl-转化率与pH关系如图2.写出pH≤2时ClO2与S2-反应的离子方程式: .
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某工厂污水中含CN-amg/L,现用ClO2将CN-氧化,生成了两种无毒无害的气体,其离子反应方程式为 ;处理100m3这种污水,至少需要ClO2 mol.

已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用.②ClO2气体在中性和碱性溶液中不能稳定存在.
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式
(2)反应生成ClO2气体需要X酸酸化,X酸可以为
A.盐酸 B.稀硫酸 C.硝酸 D.H2C2O4溶液
(3)吸收塔内的温度不能过高的原因为
(4)ClO2被S2-还原为ClO2-、Cl-转化率与pH关系如图2.写出pH≤2时ClO2与S2-反应的离子方程式:
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某工厂污水中含CN-amg/L,现用ClO2将CN-氧化,生成了两种无毒无害的气体,其离子反应方程式为
考点:物质分离和提纯的方法和基本操作综合应用,化学方程式的有关计算,氯、溴、碘及其化合物的综合应用
专题:实验设计题,元素及其化合物
分析:无隔膜电解槽中持续电解饱和氯化钠溶液,则电解生成的氯气和氢氧化钠反应生成氯酸钠溶液,通二氧化硫和X酸还原氯酸钠溶液生成二氧化氯,再用双氧水、氢氧化钠吸收反应生成亚氯酸钠,过滤的亚氯酸钠(NaClO2)溶液通过蒸发结晶得到亚氯酸钠晶体,以此解答;
(1)根据电解池中阳极失去电子结合产物书写;
(2)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在.由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸.
(3)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解.
(4)根据图象可知,pH≤2时ClO2被还原为Cl-,所以该反应的离子方程式是2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O.
(5)根据ClO2将CN-氧化,生成了两种无毒无害的气体即二氧化碳和氮气来书写;根据方程式计算;
(1)根据电解池中阳极失去电子结合产物书写;
(2)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在.由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸.
(3)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解.
(4)根据图象可知,pH≤2时ClO2被还原为Cl-,所以该反应的离子方程式是2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O.
(5)根据ClO2将CN-氧化,生成了两种无毒无害的气体即二氧化碳和氮气来书写;根据方程式计算;
解答:
解:(1)电解池中阳极失去电子,所以溶液中的氯离子在阳极失去电子,因此反应的电极反应式是Cl--6e-+6OH-=ClO3-+3H2O,故答案为:Cl--6e-+6OH-=ClO3-+3H2O.
(2)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在.由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸,故答选:B.
(3)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解,故答案为:防止H2O2分解.
(4)根据图象可知,pH≤2时ClO2被还原为Cl-,所以该反应的离子方程式是2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O,故答案为:2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O.
(5)ClO2将CN-氧化,生成了两种无毒无害的气体即二氧化碳和氮气,所以离子方程式为:2ClO2+2CN-=2Cl-+2CO2+N2↑;根据方程式1molCN-离子消耗1mol二氧化氯,所以处理100m3这种污水,至少需要ClO2为
=
,故答案为:
;
(2)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在.由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸,故答选:B.
(3)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解,故答案为:防止H2O2分解.
(4)根据图象可知,pH≤2时ClO2被还原为Cl-,所以该反应的离子方程式是2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O,故答案为:2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O.
(5)ClO2将CN-氧化,生成了两种无毒无害的气体即二氧化碳和氮气,所以离子方程式为:2ClO2+2CN-=2Cl-+2CO2+N2↑;根据方程式1molCN-离子消耗1mol二氧化氯,所以处理100m3这种污水,至少需要ClO2为
| 100×103×a×10 -3g |
| 26 |
| 100a |
| 26 |
| 100a |
| 26 |
点评:该题是高考中的常见题型,属于中等难度的试题.试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力.本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考查学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力,题目有一定的难度.

练习册系列答案
相关题目
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若X原子的最外层电子数比其次外层电子数多3个,下列说法不正确的是( )
| X | Y | |
| Z | W |
| A、原子半径:Z>X>Y |
| B、最高价氧化物对应水化物的酸性:Z>W |
| C、W的单质是制取盐酸的原料之一 |
| D、X、W的氢化物相遇会产生白烟 |
反应N2(g)+O2(g)=2NO(g),在密闭容器中进行,能加快该反应速率的是( )
| A、扩大体积使压强减小 |
| B、体积不变充入N2使压强增大 |
| C、体积不变充入He使压强增大 |
| D、压强不变充入He |
下列有关实验原理或实验操作不正确的是( )
A、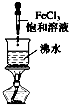 实验室制备氢氧化铁胶体 |
B、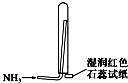 氨气的收集、检验装置 |
C、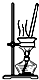 蒸发结晶获得胆矾晶体 |
D、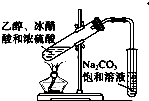 实验室制乙酸乙酯 |

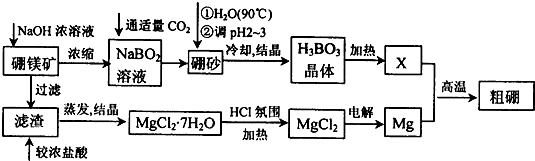
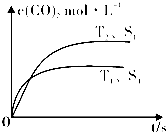 2014年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2014年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.