题目内容
为研究添加食品中的食盐中碘酸钾的稳定性,小明查阅文献得到相关信息如下,请回答
(1)相同温度下,pH= 时,碘酸钾最不稳定.
(2)PH=7时,随着温度的升高碘酸钾的稳定性 (填“增强”,“不变”或“减弱”);
(3)小明猜想,碘酸钾因转化为碘单质.请设计一个实验方案证明是否有碘单质生成:
(4)已知某含碘盐包装配料表标记:碘酸钾(以I计算,18~32mg/kg),若每袋盐以500g计算,下列说法正确的是
A、每袋盐含碘酸钾18~32mg B、每袋盐含碘酸钾9~16mg C、每袋盐含碘9~16mg
(5)写出一条使用的加碘食盐的合理化建议: .
| 编号 | 碘酸钾浓度/mol/L | PH | 碘酸钾损失率/% | |||
| 30℃ | 50℃ | 80℃ | 100℃ | |||
| 1 | 0.003 | 0 | 21 | 70.3 | 71 | 77.3 |
| 2 | 0.003 | 7 | 0 | 0.3 | 0.67 | 1 |
| 3 | 0.003 | 14 | 1.3 | 2.7 | 1.3 | 1 |
(2)PH=7时,随着温度的升高碘酸钾的稳定性
(3)小明猜想,碘酸钾因转化为碘单质.请设计一个实验方案证明是否有碘单质生成:
(4)已知某含碘盐包装配料表标记:碘酸钾(以I计算,18~32mg/kg),若每袋盐以500g计算,下列说法正确的是
A、每袋盐含碘酸钾18~32mg B、每袋盐含碘酸钾9~16mg C、每袋盐含碘9~16mg
(5)写出一条使用的加碘食盐的合理化建议:
考点:氯、溴、碘及其化合物的综合应用
专题:
分析:根据表格中数据知,相同温度下,碘酸钾损失率大小顺序为:酸性条件下>碱性条件下>中性条件下;相同pH时,温度越高,碘酸钾的损失率越大,碘与湿润的淀粉碘化钾试纸变蓝色,这是碘的特性.
解答:
解:(1)相同温度下,根据溶液的酸碱性与碘酸钾损失率之间的关系知,酸性越强,碘酸钾的损失率越大,碱性条件下碘酸钾的损失率次之,中性条件下,碘酸钾的损失率最小,pH=0时,碘酸钾的损失率最大,故答案为:0;
(2)相同pH条件下,温度越高,碘酸钾的损失率越大,所以pH=7时,随着温度的升高碘酸钾的稳定性减弱,故答案为:减弱;
(3)碘能使湿润的淀粉碘化钾试纸变蓝色,要想检验碘,用湿润的淀粉碘化钾试纸检验,如果试纸变蓝色就证明含有碘单质,
故答案为:用湿润的淀粉碘化钾试纸检验,如果试纸变蓝色就证明含有碘单质;
(4)碘酸钾(以I计算,18~32mg/kg),若每袋盐以500g计算,所含碘元素质量为0.5Kg×18mg/Kg----0.5Kg×32mg/Kg=9~16mg
所含碘酸钾质量=
×214g/mol---
×214g/mol=15--27,所以C正确,故答案为:C;
(5)根据表中碘酸钾的损失率与温度和溶液酸碱性的关系知,温度越高、酸碱性越强碘酸钾的损失率越大,所以使用的加碘食盐的建议如炒好菜时再放盐等,
故答案为:炒好菜再放盐.
(2)相同pH条件下,温度越高,碘酸钾的损失率越大,所以pH=7时,随着温度的升高碘酸钾的稳定性减弱,故答案为:减弱;
(3)碘能使湿润的淀粉碘化钾试纸变蓝色,要想检验碘,用湿润的淀粉碘化钾试纸检验,如果试纸变蓝色就证明含有碘单质,
故答案为:用湿润的淀粉碘化钾试纸检验,如果试纸变蓝色就证明含有碘单质;
(4)碘酸钾(以I计算,18~32mg/kg),若每袋盐以500g计算,所含碘元素质量为0.5Kg×18mg/Kg----0.5Kg×32mg/Kg=9~16mg
所含碘酸钾质量=
| 9mg |
| 127g/mol |
| 16mg |
| 127g/mol |
(5)根据表中碘酸钾的损失率与温度和溶液酸碱性的关系知,温度越高、酸碱性越强碘酸钾的损失率越大,所以使用的加碘食盐的建议如炒好菜时再放盐等,
故答案为:炒好菜再放盐.
点评:本题考查了物质性质实验方案的设计,正确分析表中温度、pH对碘酸钾的影响是解本题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
二氧化硅晶体是立体的网状结构,其结构如图所示.关于二氧化硅晶体的下列说法不正确的是( )
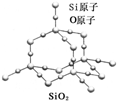

| A、晶体中Si、O原子个数比为1:2 |
| B、晶体中Si、O原子最外层都满足8电子结构 |
| C、晶体中一个硅原子含有Si-O键数目为4 |
| D、晶体中最小环上的原子数为6 |
有些垃圾可以用卫生填埋、焚烧、堆肥等方法处理.下列垃圾中,不适宜用上述方法处理的是( )
| A、果核 | B、电池 |
| C、卫生纸 | D、纯棉纺织品 |
某城市人口密度大,汽车等交通工具向大气的对流层中大量排放碳氢化合物、氮氧化物等有害物质,则下列现象最有可能发生的是( )
| A、酸雨 | B、臭氧空洞 |
| C、光化学烟雾 | D、温室效应 |
为了保护臭氧层,可采取的有效措施是( )
| A、减少二氧化硫的排放 |
| B、减少含铅废气的排放 |
| C、减少氟氯代烃的排放 |
| D、减少二氧化碳的排放 |
铝能用于冶炼难熔的金属,这是因为铝具有( )
| A、两性 |
| B、优良的导电性 |
| C、低的熔点 |
| D、还原性,且在冶炼反应中放出大量热 |
氯气是一种重要的工业原料.工业上利用反应3Cl2+2NH3═N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )
| A、若管道漏气遇氨就会产生白烟 |
| B、该反应利用了Cl2的强氧化性 |
| C、NH3发生还原反应 |
| D、生成1 mol N2有6 mol电子转移 |
