题目内容
17.某非金属元素R的氢化物及其氧化物、盐之间具有如下转化关系(部分产物省略):氢化物$\stackrel{氧气}{→}$B$\stackrel{Na_{2}O_{2}}{→}$ C,下列判断中正确的是( )| A. | 若R是硫元素、则C是Na2SO3 | B. | 若R是硅元素、则C是Na2Si03 | ||
| C. | 若R是碳元素、则C是Na2CO3 | D. | 若R是氯元素、则C是NaCl |
分析 由氢化物$\stackrel{氧气}{→}$B$\stackrel{Na_{2}O_{2}}{→}$ C可知,
A.若R是S元素,B能和过氧化钠反应,则B是SO2,SO2和Na2O2发生氧化还原反应;
B.若R是Si元素,B能和Na2O2反应,则B为H2O,C应该是NaOH;
C.若R是C元素,B能和Na2O2反应,则B为CO2,C为Na2CO3;
D.若R是Cl元素,HCl和氧气不反应.
解答 解:A.若R是S元素,B能和过氧化钠反应,则B是SO2,二氧化硫具有还原性,过氧化钠具有强氧化性,所以SO2和Na2O2发生氧化还原反应,反应方程式为Na2O2+SO2=Na2SO4,所以C是Na2SO4,故A错误;
B.若R是Si元素,B能和Na2O2反应,则B为H2O,水和过氧化钠反应方程式为2H2O+2Na2O2=4NaOH+O2↑,C应该是NaOH,故B错误;
C.若R是C元素,B能和Na2O2反应,则B为CO2,过氧化钠和二氧化碳反应方程式为2CO2+2Na2O2=2Na2CO3+O2,C为Na2CO3,故C正确;
D.若R是Cl元素,HCl和氧气不反应,所以得不到B,故D错误;
故选C.
点评 本题以C、Cl、Si、S元素为载体考查无机物推断,明确非金属元素及其化合物之间的转化是解本题关键,注意过氧化钠的强氧化性,易错选项是A,注意过氧化钠和二氧化硫能发生氧化还原反应,题目难度中等.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
7.下列有关叙述正确的是( )
| A. | 升高温度,可以使纯水中的c(H+)>c(OH-) | |
| B. | 在NaOH溶液中没有H+,在HCl溶液中没有OH- | |
| C. | 水的电离过程是一个吸热过程 | |
| D. | 将水加热,KW增大,pH不变 |
8.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | NaHSO3中:c(Na+)>c(HSO3-)>c(OH-)>c(H+) | |
| B. | Na2CO3溶液:c(OH-)═c(HCO3-)+c(H2CO3)+c(H+) | |
| C. | 等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合后,所得溶液中:c(H+)+c(M+)=c(OH-)+c(A-) |
12.下列关于物质用途的叙述中不正确的是( )
| A. | Na2O2可用作呼吸面具中的供氧剂 | |
| B. | 浓硫酸在常温下不能与铜片反应放出二氧化硫气体 | |
| C. | Al(OH)3可作治疗胃酸过多的一种药剂 | |
| D. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 |
9.某溶液中可能含有大量的下列离子:NH4+、K+、A1O2-、CO32-、SO32-、C1-中的若干种.现设计并完成了如下实验: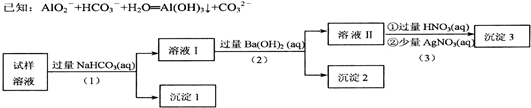
根据以上的实验操作与现象,得出的如下结论中正确的是( )

根据以上的实验操作与现象,得出的如下结论中正确的是( )
| A. | 试样溶液中若(1)加入的是稍过量的FeCl3溶液,则沉淀1物质的成分不变 | |
| B. | 试样溶液中肯定存在阴离子A1O2-、C1-,阳离子NH4+、K+至少存在1种 | |
| C. | 上述沉淀2放置在干燥空气中一段时间后,称量质量没有变化,可判断试样中无SO32- | |
| D. | 实验中,如果将操作(1)与(3)所加的试剂互换,过程中的实验现象仍会完全相同 |
6.化学与生产、生活息息相关,下列有关说法错误的是( )
| A. | 大量燃烧化石燃料是造成雾霾天气的原因之一 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 燃料脱硫和减少汽车尾气排放都能减少酸雨的产生 | |
| D. | 用食醋可以除去热水壶内壁的水垢 |
5. 已知乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
已知乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
某研究性学习小组的同学将乙醇、80%的硫酸、NaBr固体按一定比例混合后(总体积约140mL)置于图1
的反应容器B中后进行加热(两个装置中的加热、固定装置及沸石均省略).
(1)①仪器A的名称是:冷凝管;②容器B的容积是:c,
a.150mL b.200mL c.250mL
(2)两个水槽中的液体均是冰水,使用冰水的目的是降温,减少溴乙烷的挥发.
(3)HBr与乙醇反应生成目标产物的化学方程式HBr+C2H5OH$\stackrel{加热}{→}$C2H5Br+H2O.
(4)图1中收集到的产品中含有一定量的杂质Br2.为除去该杂质,可先向混合液中加入适量的(从下面所给试剂中选取)b,然后再进行分液操作即可.
a.四氯化碳 b.碳酸钠稀溶液 c.无水CaCl2 d.无水MgSO4
(5)经过(4)处理后的目标产物中还含有少量的水等杂质,可通过向产品中加入一定量的cd(从上面的a~d中选取),充分作用后,过滤,将滤液使用图2中的装置进行提纯,冷却水应从a口(填a或b)进入.
(6)若实验中使用的无水乙醇的体积是46mL,蒸馏后得到的纯溴乙烷的体积是50rnL,则溴乙烷的产率为80%.
 已知乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
已知乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:| 溶解性(本身均做溶剂) | 沸点(℃) | 密度(g/mL) | |
| 水混溶,易溶于有机溶剂 | 78.5 | 0.8 | |
| 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
的反应容器B中后进行加热(两个装置中的加热、固定装置及沸石均省略).
(1)①仪器A的名称是:冷凝管;②容器B的容积是:c,
a.150mL b.200mL c.250mL
(2)两个水槽中的液体均是冰水,使用冰水的目的是降温,减少溴乙烷的挥发.
(3)HBr与乙醇反应生成目标产物的化学方程式HBr+C2H5OH$\stackrel{加热}{→}$C2H5Br+H2O.
(4)图1中收集到的产品中含有一定量的杂质Br2.为除去该杂质,可先向混合液中加入适量的(从下面所给试剂中选取)b,然后再进行分液操作即可.
a.四氯化碳 b.碳酸钠稀溶液 c.无水CaCl2 d.无水MgSO4
(5)经过(4)处理后的目标产物中还含有少量的水等杂质,可通过向产品中加入一定量的cd(从上面的a~d中选取),充分作用后,过滤,将滤液使用图2中的装置进行提纯,冷却水应从a口(填a或b)进入.
(6)若实验中使用的无水乙醇的体积是46mL,蒸馏后得到的纯溴乙烷的体积是50rnL,则溴乙烷的产率为80%.

 .
.


