题目内容
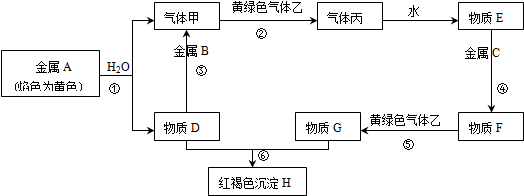
5.下列各物质的转化关系如下图所示,A是海水中含量最高的盐,B、F、I是常见的金属单质,其中I呈紫红色.C、D是气体,其中D是最轻的气体.
回答下列问题:
(1)A的化学式是NaCl.
(2)实验室常将单质B保存在煤油中.
(3)写出反应①的离子方程式Fe+2 H+=Fe2++H2↑.
(4)写出反应②化学方程式并用双线桥法表示电子转移的方向和数目
 .
.
分析 A是海水中含量最高的盐,则A为NaCl,D是最轻的气体,则D为H2,I是紫红色金属,则I为Cu.电解NaCl得到金属B与气体C,则B为Na、C为Cl2,氯气与氢气反应生成E为HCl,金属F与HCl反应生成氢气与G,G能与氯气反应生成H,H与Cu反应可以得到G,则F为变价金属,可推知F为Fe、G为FeCl2、H为FeCl3,据此解答.
解答 解:A是海水中含量最高的盐,则A为NaCl,D是最轻的气体,则D为H2,I是紫红色金属,则I为Cu.电解NaCl得到金属B与气体C,则B为Na、C为Cl2,氯气与氢气反应生成E为HCl,金属F与HCl反应生成氢气与G,G能与氯气反应生成H,H与Cu反应可以得到G,则F为变价金属,可推知F为Fe、G为FeCl2、H为FeCl3.
(1)A的化学式是NaCl,故答案为:NaCl;
(2)实验室常将单质Na保存在煤油中,故答案为:煤油;
(3)反应①的离子方程式:Fe+2 H+=Fe2++H2↑,故答案为:Fe+2 H+=Fe2++H2↑;
(4)用双线桥法表示反应②电子转移的方向和数目为: ,
,
故答案为: .
.
点评 本题考查无机物推断,“A在海水中含量、I为紫红色金属、D为最轻气体”是推断突破口,比较基础.

练习册系列答案
相关题目
16.下列化合物的核磁共振氢谱中出现三组峰的是( )
| A. | 甲苯 | B. | 1,3-丁二烯 | C. | 2-甲基丙烷 | D. | 2,4-二甲基戊烷 |
13.常温下,有下列盐:①FeCl3 ②NaClO ③NaCl,其水溶液的pH由大到小排列正确的是( )
| A. | ①>③>② | B. | ②>③>① | C. | ③>②>① | D. | ①>②>③ |
20.在高炉中,还原氧化铁的物质是( )
| A. | 二氧化碳 | B. | 铁矿石 | C. | 石灰石 | D. | 一氧化碳 |
10.已知NA为阿伏伽德罗常数,下列说法中正确的是( )
| A. | 标准状况下,22.4LBr2的物质的量为1mol | |
| B. | 1mol的氯酸钾中氯离子的数目为NA | |
| C. | 87g二氧化锰和足量的热的浓盐酸充分反应,转移的电子数为2NA | |
| D. | 250g的CuSO4•5H2O溶于1L的水,则硫酸铜的浓度为1mol/L |
17.某非金属元素R的氢化物及其氧化物、盐之间具有如下转化关系(部分产物省略):氢化物$\stackrel{氧气}{→}$B$\stackrel{Na_{2}O_{2}}{→}$ C,下列判断中正确的是( )
| A. | 若R是硫元素、则C是Na2SO3 | B. | 若R是硅元素、则C是Na2Si03 | ||
| C. | 若R是碳元素、则C是Na2CO3 | D. | 若R是氯元素、则C是NaCl |
13.下列有关化学平衡和速率的说法正确的是( )
| A. | H2、I2、HI平衡混合气体加压后颜色不变 | |
| B. | 恒温恒压的密闭体系中进行的合成氨反应,达到平衡后,充入惰性气体,氨气的体积分数增大 | |
| C. | 红棕色的NO2气体加压后,颜色先变深,后变浅 | |
| D. | 任意温度下都能自发的反应一定是放热和熵减的反应 |
 (1)某气态有机物X含C、H、O三种元素,已知下列条件,现欲确定X的分子式,所需的最少条件组合是①②④.(填相应的数字序号)
(1)某气态有机物X含C、H、O三种元素,已知下列条件,现欲确定X的分子式,所需的最少条件组合是①②④.(填相应的数字序号)