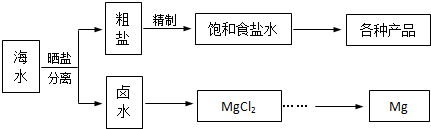
题目内容
将铜片投入到稀硫酸中,铜片不溶,加入下列试剂后,可使铜片溶解的是( )
| A、稀盐酸 | B、硫酸钠晶体 |
| C、硝酸钠晶体 | D、氯化铁晶体 |
考点:铜金属及其重要化合物的主要性质
专题:元素及其化合物
分析:先考虑铜和稀硫酸不反应,再考虑加入某些物质后能否转化为和铜反应的物质,注意硝酸盐在酸性条件下具有强氧化性来解答.
解答:
解:A、加入盐酸后,溶液中的主要离子为:H+、Cl-、SO42-,铜片不溶解,故A错误;
B、加入硫酸钠晶体后,溶液中存在的主要离子为:Na+、H+、SO42-,铜片不溶解,故B错误;
C、加入硝酸钠晶体后,溶液中存在的主要离子为:Na+、H+、NO3-、SO42-,Cu与H+、NO3-、发生氧化还原反应使铜片溶解,故C正确;
D、加入氯化铁晶体后,溶液中存在的主要离子为:H+、SO42-、Cl-、Fe3+,铜片与Fe3+发生氧化还原反应使铜片溶解,故D正确;
故选CD.
B、加入硫酸钠晶体后,溶液中存在的主要离子为:Na+、H+、SO42-,铜片不溶解,故B错误;
C、加入硝酸钠晶体后,溶液中存在的主要离子为:Na+、H+、NO3-、SO42-,Cu与H+、NO3-、发生氧化还原反应使铜片溶解,故C正确;
D、加入氯化铁晶体后,溶液中存在的主要离子为:H+、SO42-、Cl-、Fe3+,铜片与Fe3+发生氧化还原反应使铜片溶解,故D正确;
故选CD.
点评:本题考查的是铜金属及其化合物、硝酸的化学性质,挖掘隐含条件是解决本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
生物炼铜实际上是微生物帮助我们从矿石中提取铜.这些“吃岩石的细菌”能利用空气中的氧气将不溶性的CuS转化成可溶性铜的化合物,该化合物是( )
| A、碳酸铜 | B、硝酸铜 |
| C、硫酸铜 | D、氢氧化铜 |
设NA为阿伏加德罗常数的值,下列叙述不正确的( )
| A、10g质量分数为46%的乙醇的水溶液中,氢原子的总数为0.6NA |
| B、5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2NA |
| C、50 mL 12 mol?L-1 浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA |
| D、常温常压下,46g NO2与N2O4的混合气体中含有的原子总数为3NA |
 电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O.下列说法不正确的是( )
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O.下列说法不正确的是( )| A、右侧发生的电极方程式:2H2O+2e-=H2↑+2OH- | ||||
| B、电解结束时,右侧溶液中含有IO3- | ||||
C、电解槽内发生反应的总化学方程式KI+3H2O
| ||||
| D、如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 |
 如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置.
如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置.
 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究.回答下列问题: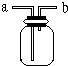 如图所示是中学化学实验中常见的装置,它有多种用途.
如图所示是中学化学实验中常见的装置,它有多种用途.