题目内容
设NA为阿伏加德罗常数的值,下列叙述不正确的( )
| A、10g质量分数为46%的乙醇的水溶液中,氢原子的总数为0.6NA |
| B、5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2NA |
| C、50 mL 12 mol?L-1 浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA |
| D、常温常压下,46g NO2与N2O4的混合气体中含有的原子总数为3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、乙醇溶液中氢原子有两部分,分别来自水和乙醇,其中水的物质的量是0.15mol,乙醇的物质的量是0.05mol;
B、5.6g铁物质的量是0.1mol,反应消耗0.15mol氯气,显然氯气不足;
C、浓盐酸分别稀盐酸,反应会停止,生成的氯气小于0.15mol;
D、46g NO2与N2O4的混合气体,组成上相当于是1mol二氧化氮.
B、5.6g铁物质的量是0.1mol,反应消耗0.15mol氯气,显然氯气不足;
C、浓盐酸分别稀盐酸,反应会停止,生成的氯气小于0.15mol;
D、46g NO2与N2O4的混合气体,组成上相当于是1mol二氧化氮.
解答:
解:A、乙醇溶液中,水的物质的量是0.3mol,氢原子0.6mol;乙醇的物质的量是0.1mol,氢原子0.6mol,故氢原子的总数为1.2NA,故A错误;
B、铁的物质的量是0.1mol,完全反应消耗0.15mol氯气,氯气不足,反应按照氯气的量进行,反应转移电子数为 0.2NA,故B正确;
C、浓盐酸的物质的量是0.6mol,完全反应生成氯气0.15mol,由于浓盐酸变成稀盐酸,变化继续反应,故生成的氯气小于0.15mol,转移电子数小于0.3 NA,故C错误;
D、组成上,可以把46g NO2与N2O4的混合气体看成46g的二氧化氮,物质的量是1mol,含有3mol原子,含有的原子总数为3NA,故D正确;
故选AC.
B、铁的物质的量是0.1mol,完全反应消耗0.15mol氯气,氯气不足,反应按照氯气的量进行,反应转移电子数为 0.2NA,故B正确;
C、浓盐酸的物质的量是0.6mol,完全反应生成氯气0.15mol,由于浓盐酸变成稀盐酸,变化继续反应,故生成的氯气小于0.15mol,转移电子数小于0.3 NA,故C错误;
D、组成上,可以把46g NO2与N2O4的混合气体看成46g的二氧化氮,物质的量是1mol,含有3mol原子,含有的原子总数为3NA,故D正确;
故选AC.
点评:本题考查阿伏伽德罗常数,注意浓盐酸制取氯气的反应,浓盐酸不会完全反应,本题难度中等.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
由以下两种途径制铜:
(1)CuO
CuSO4
Cu
(2)Zn
H2
Cu
假设每一步反应都完全,要制得等质量的铜,两个途径相比较,下列有关说法正确的是( )
(1)CuO
| H2SO4 |
| Zn |
(2)Zn
| H2SO4 |
| CuO |
假设每一步反应都完全,要制得等质量的铜,两个途径相比较,下列有关说法正确的是( )
| A、消耗等物质的量的Zn、H2SO4、CuO |
| B、所有反应类型都相同 |
| C、过程中产生的ZnSO4质量相同 |
| D、只有CuO消耗的质量相同 |
若以w1和w2分别表示浓度为amol/L和bmol/L氨水的质量分数,且知2w1=w2,则下列推断正确的是( )
| A、2a=b |
| B、2b=a |
| C、b>2a |
| D、1/2b<a<b |
下列陈述ⅠⅡ正确并且有因果关系的是( )


| A、A | B、B | C、C | D、D |
将铜片投入到稀硫酸中,铜片不溶,加入下列试剂后,可使铜片溶解的是( )
| A、稀盐酸 | B、硫酸钠晶体 |
| C、硝酸钠晶体 | D、氯化铁晶体 |
下列关于物质的检验说法正确的是( )
| A、加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子 |
| B、钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取固体氯化钾,进行灼烧,直接观察火焰颜色 |
| C、加入NaOH溶液,加热,放出能使湿润的红色石蕊试纸变蓝的气体,证明一定含有NH4+ |
| D、加入AgNO3溶液,有白色沉淀生成,证明含有Cl- |

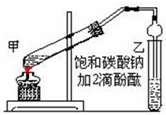 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下: