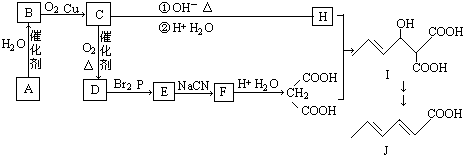
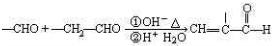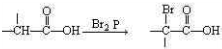题目内容
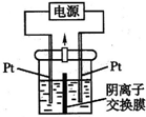 电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O.下列说法不正确的是( )
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O.下列说法不正确的是( )| A、右侧发生的电极方程式:2H2O+2e-=H2↑+2OH- | ||||
| B、电解结束时,右侧溶液中含有IO3- | ||||
C、电解槽内发生反应的总化学方程式KI+3H2O
| ||||
| D、如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 |
考点:电解原理
专题:
分析:在一定的电压下通电,发现左侧溶液变蓝色,说明左侧铂丝上有碘生成,则左侧铂丝是阳极,电极反应式为2I--2e-=I2,一段时间后,蓝色逐渐变浅,说明发生反应3I2+6OH-=IO3-+5I-+3H2O,右侧铂丝是阴极,阴极上氢离子放电,电极反应式为2H2O+2e-=H2↑+2OH-,为保证两边溶液呈电中性,左侧的IO3-通过阴离子交换膜向右侧移动,如果用阳离子交换膜代替阴离子交换膜,左侧多余K+通过阳离子交换膜迁移至阴极,保证两边溶液呈电中性,据此分析解答.
解答:
解:在一定的电压下通电,发现左侧溶液变蓝色,说明左侧铂丝上有碘生成,则左侧铂丝是阳极,电极反应式为 2I--2e-=I2,一段时间后,蓝色逐渐变浅,说明发生反应3I2+6OH-=IO3-+5I-+3H2O,右侧铂丝是阴极,阴极上氢离子放电,电极反应式为2H2O+2e-=H2↑+2OH-,保证两边溶液呈电中性,左侧的IO3-通过阴离子交换膜向右侧移动,如果用阳离子交换膜代替阴离子交换膜,左侧多余K+通过阳离子交换膜迁移至阴极,保证两边溶液呈电中性,
A.通过以上分析知,右侧发生的电极方程式:2H2O+2e-=H2↑+2OH-,故A正确;
B.一段时间后,蓝色变浅,发生反应3I2+6OH-=IO3-+5I-+3H2O,中间为阴离子交换膜,右侧I-、OH-通过阴离子交换膜向左侧移动,保证两边溶液呈电中性,左侧的IO3-通过阴离子交换膜向右侧移动,故右侧溶液中含有IO3-,故B正确;
C.通过以上分析知,电池反应式为KI+3H2O
KIO3+3H2↑,故C正确;
D.如果用阳离子交换膜代替阴离子交换膜,左侧电极为阳极,电极反应为:2I--2e-=I2,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,保证两边溶液呈电中性,左侧多余K+通过阳离子交换膜迁移至阴极,左侧生成I2,右侧溶液中有KOH生成,碘单质与KOH不能反应,总反应相当于:2KI+2H2O
2KOH+I2+H2↑,故D错误;
故选D.
A.通过以上分析知,右侧发生的电极方程式:2H2O+2e-=H2↑+2OH-,故A正确;
B.一段时间后,蓝色变浅,发生反应3I2+6OH-=IO3-+5I-+3H2O,中间为阴离子交换膜,右侧I-、OH-通过阴离子交换膜向左侧移动,保证两边溶液呈电中性,左侧的IO3-通过阴离子交换膜向右侧移动,故右侧溶液中含有IO3-,故B正确;
C.通过以上分析知,电池反应式为KI+3H2O
| ||
D.如果用阳离子交换膜代替阴离子交换膜,左侧电极为阳极,电极反应为:2I--2e-=I2,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,保证两边溶液呈电中性,左侧多余K+通过阳离子交换膜迁移至阴极,左侧生成I2,右侧溶液中有KOH生成,碘单质与KOH不能反应,总反应相当于:2KI+2H2O
| ||
故选D.
点评:本题考查电解原理,明确各个电极上发生的反应及离子移动方向是解本题关键,易错选项是D,注意离子交换膜的选择性,导致碘和KOH不反应,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设NA代表阿佛加德罗常数的数值,下列说法中正确的是( )
| A、常温常压下,17g甲基(-14CH3)所含的中子数为8NA |
| B、64g的铜发生氧化还原反应,一定失去2 NA个电子 |
| C、常温常压22.4LNO气体的分子数为NA |
| D、标况时,22.4L三氯甲烷所含有的分子数为NA |
若以w1和w2分别表示浓度为amol/L和bmol/L氨水的质量分数,且知2w1=w2,则下列推断正确的是( )
| A、2a=b |
| B、2b=a |
| C、b>2a |
| D、1/2b<a<b |
下列陈述ⅠⅡ正确并且有因果关系的是( )


| A、A | B、B | C、C | D、D |
将铜片投入到稀硫酸中,铜片不溶,加入下列试剂后,可使铜片溶解的是( )
| A、稀盐酸 | B、硫酸钠晶体 |
| C、硝酸钠晶体 | D、氯化铁晶体 |
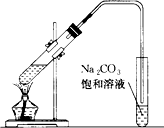 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.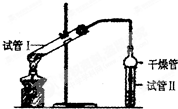 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH