题目内容
11.表是元素周期表的一部分,针对表中①~⑩中元素,用元素符号或化学式填空回答以下问题:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)①~⑩元素的最高价氧化物对就的水化物中酸性最强的是HClO4,碱性最强的是KOH;
(3)按要求写出下列两种物质的电子式:①的氢化物
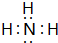 ;⑨的最高价氧化物对应的水化物
;⑨的最高价氧化物对应的水化物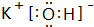 ;
;(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用1个化学反应说明该事实(写出反应的化学方程式):Cl2+2KBr═2KCl+Br2.
分析 由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为Cl,⑧为Ar,⑨为K,⑩为Br,
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强(氟元素没有最高价含氧酸),元素的金属性越强,其最高价氧化物的水化物碱性越强;
(3)①的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对;⑨的最高价氧化物的对应的水化物为KOH,由钾离子与氢氧根离子构成;
(4)同主族自上而下非金属性减弱,单质活泼性减弱,可以用单质之间的相互置换说明该事实.
解答 解:由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为Cl,⑧为Ar,⑨为K,⑩为Br,
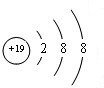
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故上述元素中F原子半径最小,K原子半径最大,K+离子结构示意图为: ,
,
故答案为:F;K; ;
;
(2)F元素没有最高价含氧酸,上述元素中最高价氧化物对应的水化物的酸性最强是HClO4,K的金属性最强,则KOH的碱性最强;
故答案为:HClO4;KOH;
(3)①的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,其电子式为: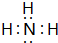 ;⑨的最高价氧化物的对应的水化物为KOH,由钾离子与氢氧根离子构成,其电子式为:
;⑨的最高价氧化物的对应的水化物为KOH,由钾离子与氢氧根离子构成,其电子式为: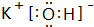 ,
,
故答案为: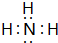 ;
;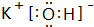 ;
;
(4)同主族自上而下非金属性减弱,单质活泼性减弱,故活泼性Cl2>Br2,可以用单质之间的相互置换说明该事实,反应方程式为:Cl2+2KBr═2KCl+Br2,
故答案为:Cl2;Cl2+2KBr═2KCl+Br2.
点评 本题考查位置结构性质关系的应用,需要学生熟悉元素在周期表结构,注意掌握金属性、非金属性强弱比较事实.

 阅读快车系列答案
阅读快车系列答案 纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)己知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(s)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=2c-a-bkJ•mol-1.
(3)方法II采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
(4)方法III为加热条件下用液态拼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0
水蒸气的浓度随时间t变化如表所示.
| 序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
A.实验温度:T1<T2
B.实验①前20min的平均反应速率v(O2)=7×10-5mol/(L•min)
C.实验②比实验①所用的催化剂效率高
(6)25℃时,向50mL0.018mol/L的AgNO3溶液中加入50mL0.02mol/L盐酸,生成沉淀.若已知Ksp(AgCl)=1.8×10-10,则此时溶液中的c(Ag+)=1.8×10-7mol/L.(体积变化忽略不计)若再向沉淀生成后的溶液中加入100mL0.001mol/L盐酸,是否继续产生沉淀否(填“是”或“否”).
| A. | 乙烯通入溴的四氯化碳溶液中,溶液褪色 | |
| B. | 光照甲烷和氯气的混合气体后,瓶壁上有油状液滴附着 | |
| C. | 苯滴加到溴水中,震荡后水层接近无色 | |
| D. | 在葡萄糖溶液中加入新制的氢氧化铜,加热后产生砖红色沉淀 |
| A. | 着色 | B. | 防腐 | C. | 调味 | D. | 杀菌 |
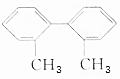 ,请完成下列空白:
,请完成下列空白: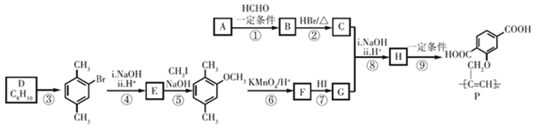
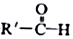 $\stackrel{一定条件}{→}$R-C≡
$\stackrel{一定条件}{→}$R-C≡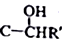
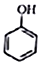 +CH2I$\stackrel{NaOH}{→}$
+CH2I$\stackrel{NaOH}{→}$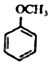 +NaI+H2O
+NaI+H2O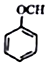 +HI→
+HI→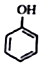 +CH2I
+CH2I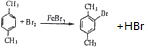 .
.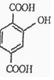 .
.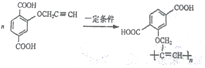 .
.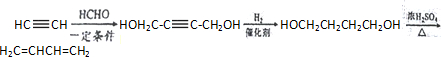 .
.