题目内容
1.某化学研究性学习小组通过查阅资料知:Fe2O3有可能被H2还原为Fe3O4.为此他们用磁铁吸出H2还原Fe2O3得到的黑色粉末X.进行如下研究:(1)甲同学认为X能被磁铁吸附,因此X是铁.甲同学的结论可靠吗?为什么?不可靠,因为磁铁矿也有磁性,能被磁铁吸引.
(2)乙同学:取少量X放入装有足量硫酸铜溶液的烧杯中,充分振荡后静置发现有少量红色物质析出,过滤后将滤渣加入到盐酸中,稍后向所得溶液滴加2滴KSCN溶液,溶液出现红色.
滴加KSCN溶液的目的是:检验三价铁离子,进而验证四氧化三铁存在.
(3)丙同学的实验方案:

①加入H2O2时反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,操作Z是过滤,灼烧沉淀时所用仪器的名称是坩埚.
②通过以上数据,得出2.88g黑色粉末X中各成分的物质的量为n(Fe3O4)=0.01mol、n(Fe)=0.01mol.
分析 (1)根据Fe、Fe3O4能被磁铁吸附来回答;
(2)取少量X放入装有足量硫酸铜溶液的烧杯中,铁和硫酸铜反应生成亚铁离子,四氧化三铁和硫酸铜不反应,有少量红色物质析出为置换出的铜,过滤后将滤渣加入到盐酸中,铜和盐酸不反应,四氧化三铁可以和盐酸反应,铁离子遇到硫氰化钾显示血红色;
(3)①黑色粉末加入过量盐酸溶解后,加入加入H2O2时,亚铁离子被氧化成铁离子,加入足量氨水沉淀离子,操作Z是过滤、洗涤得到沉淀,灼烧沉淀在坩埚内烧制;
②依据反应的化学方程式,结合铁元素守恒计算判断.
解答 解:(1)黑色粉末能被磁铁吸附,Fe、Fe3O4能被磁铁吸附,故不能由此确定X就是铁单质,
故答案为:不可靠,因为磁铁矿也有磁性,能被磁铁吸引;
(2)①滴加几滴KSCN溶液,溶液出现血红色,可以证明存在Fe3+,进而证明黑色固体中含有四氧化三铁,确认Fe3O4的存在,
故答案为:检验三价铁离子,进而验证四氧化三铁存在;
②X的组成是Fe和Fe3O4,向其中加入盐酸,Fe3O4溶于其中得到氯化铁溶液会和金属铁之间反应得到氯化亚铁,即Fe+2Fe3+=3Fe2+,不会使KSCN变色,
故答案为:Fe+2Fe3+=3Fe2+;
(3)①流程是黑色粉末加入过量盐酸溶解后,加入加入H2O2溶液与二价铁离子发生氧化还原反应,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,加入足量碱离子全部沉淀,操作Z是过滤、洗涤得到沉淀,洗涤得到沉淀,放在坩埚内灼烧制恒重得到红褐色固体为氧化铁;
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;过滤;坩埚;
②发生Fe+Fe3O4$\stackrel{足量盐酸}{→}$FeCl2、FeCl3$\stackrel{H_{2}O_{2}}{→}$Fe3+$\stackrel{足量碱}{→}$Fe(OH)2 Fe(OH)3$\stackrel{灼烧恒重}{→}$Fe2O3;依据反应过程中铁元素守恒,3.2gFe2O3物质的量=$\frac{3.2g}{160g/mol}$=0.02mol;设铁物质的量为X,四氧化三铁物质的量为Y,得到:56X+232Y=2.88,X+3Y=0.02×2,解方程得到X=0.01mol;Y=0.01mol;
即n(Fe3O4)=0.01mol;n(Fe)=0.01mol.
故答案为:n(Fe3O4)=0.01mol、n(Fe)=0.01mol.
点评 本题考查了探究物质组成,测定物质含量的定量实验操作和实验设计,主要考查铁及其化合物的性质应用,实验基本操作的分析判断,实验现象的推断和应用,元素守恒的计算应用,综合性较强,题目难度中等.

| A. | v1增大,v2减小 | B. | v1减小,v2增大 | C. | 同时增大 | D. | 同时减小 |
①A元素的原子半径在周期表中最小
②B元素原子的最外层电子数是次外层电子数的两倍
③C元素最高价氧化物的水化物和氢化物反应生成盐
④D元素和E元素可形成E2D、E2D2两种离子化合物
⑤H、D两元素同主族,G、H两元素同周期
⑥G元素是同周期中离子半径最小的元素.回答下列问题:
(1)写出B、H两种元素形成化合物的结构式S=C=S,A、D、E三种元素形成的化合物的电子式
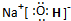 ,写出③中生成盐的化学键类型离子键和共价键.
,写出③中生成盐的化学键类型离子键和共价键.(2)甲、乙、丙分别是B、G、H三种元素最高价含氧酸的钠盐(包括酸式盐),甲、乙都能与丙发生反应,且丙用量不同,反应产物不同.则向甲溶液中缓慢滴加过量的丙溶液,可观察到的实验现象是开始无明显现象,后来生成大量无色气体,向乙溶液中缓慢滴加过量的丙溶液发生的离子反应方程式为H++AlO2-+H2O=Al(OH)3↓和Al(OH)3+3H+=Al3++3H2O.
(3)由元素F和I形成的氢氧化物难溶于水,常温下它们的溶度积如下:
| 物质 | F(OH)2 | I(OH)3 |
| Ksp | 5.61×10-12 | 2.64×10-39 |
| A. | C5H12 | B. | C4H10 | C. | C3H8 | D. | C2H6 |
| A. | CsF | B. | NaF | C. | LiI | D. | KCl |
| A. | 原子半径X>Y | B. | 氢化物稳定性H2X>HY | ||
| C. | 原子核内质子数R<M | D. | 溶液碱性R(OH)2<M(OH)2 |




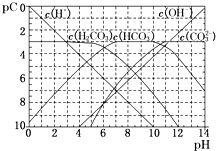 研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义.某学习小组查阅资料并进行相关探究,请帮忙完成以下探究.
研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义.某学习小组查阅资料并进行相关探究,请帮忙完成以下探究.