题目内容
16.A、B、C、D、E、F、G、H是元素周期表中八种原子序数依次增大的短周期元素,I是地壳中含量位于第二位的金属元素.已知①A元素的原子半径在周期表中最小
②B元素原子的最外层电子数是次外层电子数的两倍
③C元素最高价氧化物的水化物和氢化物反应生成盐
④D元素和E元素可形成E2D、E2D2两种离子化合物
⑤H、D两元素同主族,G、H两元素同周期
⑥G元素是同周期中离子半径最小的元素.回答下列问题:
(1)写出B、H两种元素形成化合物的结构式S=C=S,A、D、E三种元素形成的化合物的电子式
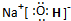 ,写出③中生成盐的化学键类型离子键和共价键.
,写出③中生成盐的化学键类型离子键和共价键.(2)甲、乙、丙分别是B、G、H三种元素最高价含氧酸的钠盐(包括酸式盐),甲、乙都能与丙发生反应,且丙用量不同,反应产物不同.则向甲溶液中缓慢滴加过量的丙溶液,可观察到的实验现象是开始无明显现象,后来生成大量无色气体,向乙溶液中缓慢滴加过量的丙溶液发生的离子反应方程式为H++AlO2-+H2O=Al(OH)3↓和Al(OH)3+3H+=Al3++3H2O.
(3)由元素F和I形成的氢氧化物难溶于水,常温下它们的溶度积如下:
| 物质 | F(OH)2 | I(OH)3 |
| Ksp | 5.61×10-12 | 2.64×10-39 |
分析 A、B、C、D、E、F、G、H是元素周期表中八种原子序数依次增大的短周期元素,I是地壳中含量位于第二位的金属元素,则I为Fe元素;
①A元素的原子半径在周期表中最小,A为H元素;
②B元素的原子最外层电子数是次外层电子数的两倍,有2个电子层,最外层电子数为4,B为C元素;
③C元素的最高价氧化物的水化物和氢化物反应生成盐,C为N元素;
④D元素和E元素可以形成E2D、E2D2两种离子化合物,E为Na元素,D为O元素;
⑤H、D两元素同主族,D为O元素,则H为S元素;G、H两元素同周期,处于第三周期;
⑥G原子序数大于Na,在第三周期,而且G元素是同周元素中离子半径最小的元素,则G为Al元素,F元素的原子序数介于Na与Al之间,则F为Mg元素;
(1)B、H形成的化合物为CS2,A、D、E三种元素形成的化合物是NaOH,属于离子化合物,由钠离子与氢氧根离子构成;③中生成盐为氯化铵;
(2)甲、乙、丙分别是C、Al、S三种元素最高价含氧酸的钠盐(包括酸式盐),甲、乙都能与丙发生反应,且丙用量不同,反应产物不同,则甲是Na2CO3,乙是NaAlO2,丙是NaHSO4,则向Na2CO3溶液中缓慢滴加过量的NaHSO4溶液,开始生成碳酸氢钠和硫酸钠,后来生成二氧化碳和硫酸钠;向NaAlO2溶液中缓慢滴加过量的NaHSO4溶液,先生成氢氧化铝沉淀,后沉淀逐渐溶解;
(3)根据氢氧化镁和氢氧化铁的溶解平衡以及溶度积表达式计算.
解答 解:A、B、C、D、E、F、G、H是元素周期表中八种原子序数依次增大的短周期元素,I是地壳中含量位于第二位的金属元素,则I为Fe元素;
①A元素的原子半径在周期表中最小,A为H元素;
②B元素的原子最外层电子数是次外层电子数的两倍,有2个电子层,最外层电子数为4,B为C元素;
③C元素的最高价氧化物的水化物和氢化物反应生成盐,C为N元素;
④D元素和E元素可以形成E2D、E2D2两种离子化合物,E为Na元素,D为O元素;
⑤H、D两元素同主族,D为O元素,则H为S元素;G、H两元素同周期,处于第三周期;
⑥G原子序数大于Na,在第三周期,而且G元素是同周元素中离子半径最小的元素,则G为Al元素,F元素的原子序数介于Na与Al之间,则F为Mg元素;
(1)B、H形成的化合物为CS2,其结构式为S=C=S;A、D、E三种元素形成的化合物是NaOH,属于离子化合物,由钠离子与氢氧根离子构成,电子式为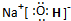 ,③中生成盐为氯化铵,氯化铵中存在离子键和共价键;
,③中生成盐为氯化铵,氯化铵中存在离子键和共价键;
故答案为:S=C=S;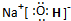 ;离子键和共价键;
;离子键和共价键;
(2)甲、乙、丙分别是C、Al、S三种元素最高价含氧酸的钠盐(包括酸式盐),甲、乙都能与丙发生反应,且丙用量不同,反应产物不同,则甲是Na2CO3,乙是NaAlO2,丙是NaHSO4,则向Na2CO3溶液中缓慢滴加过量的NaHSO4溶液,开始生成碳酸氢钠和硫酸钠,后来生成二氧化碳和硫酸钠,所以可观察到的实验现象是:开始无明显现象,后来生成大量无色气体;向NaAlO2溶液中缓慢滴加过量的NaHSO4溶液,先生成氢氧化铝沉淀,后沉淀逐渐溶解,发生的离子反应方程式为:H++AlO2-+H2O=Al(OH)3↓,Al(OH)3+3H+=Al3++3H2O,
故答案为:开始无明显现象,后来生成大量无色气体;H++AlO2-+H2O=Al(OH)3↓;Al(OH)3+3H+=Al3++3H2O;
(3)向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,溶液中c(OHOH-)=10-6mol/L,c(Mg2+)=$\frac{Ksp}{{c}^{2}(O{H}^{-})}$=$\frac{5.61×1{0}^{-12}}{(1{0}^{-6})^{2}}$=5.61mol/L,c(Fe3+)=$\frac{Ksp}{{c}^{3}(O{H}^{-})}$=$\frac{2.64×1{0}^{-39}}{(1{0}^{-6})^{3}}$=2.64×10-21mol/L,所以 c(Mg2+):c(Fe3+)=5.61:2.64×10-21=2.125×1021,
故答案为:2.125×1021.
点评 本题以元素推断为载体,考查常用化学用语书写、化学键、元素化合物的性质、溶度积常数的有关计算等,题目综合性较大,侧重于考查学生的分析能力和计算能力,注意基础知识的理解掌握.

 阅读快车系列答案
阅读快车系列答案| A. | 溶液的导电性与溶液中离子的浓度有关 | |
| B. | 溶液的导电性与溶液中离子数目的多少有关 | |
| C. | 恰好完全反应时,溶液不易导电,所以BaSO4和水都是弱电解质 | |
| D. | 往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
| A. | 开发利用太阳能、风能等,减少对化石能源的依赖 | |
| B. | 监测大气中的PM2.5,改善空气质量 | |
| C. | 大力实施矿物燃料和脱硫脱硝技术以减少SO2、NOx的排放 | |
| D. | 加高工厂烟囱,使烟尘和废气远离地表 |
| A. | 低温、低压 | B. | 低温、高压 | C. | 高温、高压 | D. | 高温、低压 |
| A. | 碳和一氧化碳 | B. | 1mol 碳和2mol 碳 | ||
| C. | 1mol 乙炔和2mol 碳 | D. | 淀粉和纤维素 |
| A. | NH3和HCl | B. | NH3和O2 | C. | SO3和H2S | D. | NO和O2 |
| A. | 温度只能改变某一个方向的反应速率 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 反应体系中混合物的组成保持不变 | |
| D. | 正、逆反应速率相等但不为零 |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
