题目内容
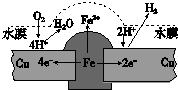 铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图.下列说法不正确的是( )
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图.下列说法不正确的是( )| A、因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 |
| B、若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小 |
| C、铜极上的反应是2H++2e-═H2↑,O2+4e-+4H+═2H2O |
| D、在金属表面涂一层油脂,能防止铁铆钉被腐蚀 |
考点:金属的电化学腐蚀与防护
专题:电化学专题
分析:根据图片知,水中溶解了氧气,铜、铁和水构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应;结合金属防护原理分析.
解答:
解:A、Fe的活泼性比Cu强,Fe做负极失电子被氧化而腐蚀,故A正确;
B、若水膜中溶解了SO2,水膜的酸性会增强,则铁铆钉腐蚀的速率变大,故B错误;
C、根据图片可知左侧Cu上发生吸氧腐蚀,右侧Cu上发生析氢腐蚀,则铜极上的反应是2H++2e-═H2↑,O2+4e-+4H+═2H2O,故C正确;
D、在金属表面涂一层油脂,能使金属与氧气隔离,不能构成原电池,所以能防止铁铆钉被腐蚀,故D正确;
故选B.
B、若水膜中溶解了SO2,水膜的酸性会增强,则铁铆钉腐蚀的速率变大,故B错误;
C、根据图片可知左侧Cu上发生吸氧腐蚀,右侧Cu上发生析氢腐蚀,则铜极上的反应是2H++2e-═H2↑,O2+4e-+4H+═2H2O,故C正确;
D、在金属表面涂一层油脂,能使金属与氧气隔离,不能构成原电池,所以能防止铁铆钉被腐蚀,故D正确;
故选B.
点评:本题以原电池原理为载体考查了金属的腐蚀,难度不大,明确钢铁发生析氢腐蚀和吸氧腐蚀的条件是解本题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
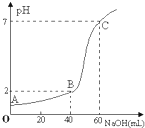 常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述正确的是( )
常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述正确的是( )| A、所用HCl的浓度是0.09mol?L-1,NaOH溶液浓度为0.03mol?L-1 |
| B、在B点,溶液中离子浓度关系为:c(Cl-)>c(Na+)>c(H+)>c(OH-) |
| C、A.B.C三点水的电离程度大小依次为:A>B>C |
| D、滴定前,锥形瓶用待测液润洗,导致HCl浓度偏低 |
下列反应的离子方程式正确的是( )
| A、过量氯气通入溴化亚铁溶液中:2Cl2+2Fe2++2Br-═4Cl-+2Fe3++Br2 |
B、向苯酚溶液中滴加Na2CO3溶液: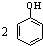 +CO32-→ +CO32-→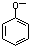 +CO2↑+H2O +CO2↑+H2O |
| C、足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
| D、用过量的冷氨水吸收SO2:SO2+2NH3?H2O═SO32-+2NH4++H2O |
设表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A、22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA |
| B、常温下,1L O.1mol/L NH4NO3的溶液中含氮原子数为0.2NA |
| C、室温下,21.Og乙烯和丁烯的混合气体中含有的碳原子数目为NA |
| D、含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L |
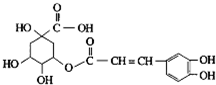 金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )| A、绿原酸的分子式为C16H8O9 |
| B、1mol绿原酸最多与4mol NaOH反应 |
| C、1个绿原酸分子中含有4个手性碳原子 |
| D、绿原酸分子中有4种化学环境不同的氢原子 |
 关于如图所示转化关系(X代表卤素),说法不正确的是( )
关于如图所示转化关系(X代表卤素),说法不正确的是( )| A、2H(g)+2X(g)═2HX(g)△H3<0 |
| B、途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3 |
| C、Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多 |
| D、途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定 |
芳香化合物M的结构简式为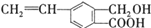 ,关于有机物M的说法正确的是( )
,关于有机物M的说法正确的是( )
 ,关于有机物M的说法正确的是( )
,关于有机物M的说法正确的是( )| A、有机物M的分子式为C10H12O3 |
| B、1mol Na2CO3最多能消耗1mol有机物M |
| C、1mol M和足量金属钠反应生成22.4L气体 |
| D、有机物M能发生取代、氧化和加成反应 |
 A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表: