题目内容
 关于如图所示转化关系(X代表卤素),说法不正确的是( )
关于如图所示转化关系(X代表卤素),说法不正确的是( )| A、2H(g)+2X(g)═2HX(g)△H3<0 |
| B、途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3 |
| C、Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多 |
| D、途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、原子形成化学键放热,焓变小于0;
B、依据盖斯定律分析,反应焓变与起始物质和终了物质有关于变化途径无关;
C、途径Ⅱ是断裂化学键的过程,是吸热过程,Cl、Br、I的原子半径依次增大,Cl2、Br2、I2,断裂化学键需要能量减小;
D、根据化学反应所吸收或放出的能量即为反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差来判断;
B、依据盖斯定律分析,反应焓变与起始物质和终了物质有关于变化途径无关;
C、途径Ⅱ是断裂化学键的过程,是吸热过程,Cl、Br、I的原子半径依次增大,Cl2、Br2、I2,断裂化学键需要能量减小;
D、根据化学反应所吸收或放出的能量即为反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差来判断;
解答:
解:A、原子形成化学键放热,焓变小于0,2H(g)+2X(g)═2HX(g)△H3<0,故A正确;
B、反应焓变与起始物质和终了物质有关于变化途径无关,途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3 ,故B正确;
C、Cl、Br、I的原子半径依次增大,Cl2、Br2、I2,断裂化学键需要能量减小,所以途径Ⅱ吸收的热量依次减小,故C错误;
D、因化学反应所吸收或放出的能量即为反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差,氯原子半径小于溴原子,途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定,故D正确;
故选C.
B、反应焓变与起始物质和终了物质有关于变化途径无关,途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3 ,故B正确;
C、Cl、Br、I的原子半径依次增大,Cl2、Br2、I2,断裂化学键需要能量减小,所以途径Ⅱ吸收的热量依次减小,故C错误;
D、因化学反应所吸收或放出的能量即为反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差,氯原子半径小于溴原子,途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定,故D正确;
故选C.
点评:本题考查了合成反应能量变化,反应焓变分析判断,物质结构和同主族性质变化规律是解题关键,题目难度中等.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
X、Y、Z、W、R 5种短周期元素,其原子序数依次增大.X是元素周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )
| A、Z与Y两种元素组成的化合物中,阴、阳离子个数比为1:1或1:2 |
| B、Y、Z、W元素形成的简单离子具有相同电子层结构,其离子半径依次增大 |
| C、Z、R元素的氧化物的水化物之间相互反应生成的盐溶液呈中性、碱性或酸性 |
| D、Y、R元素分别与X元素形成的化合物的沸点:XmY<XmR |
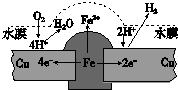 铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图.下列说法不正确的是( )
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图.下列说法不正确的是( )| A、因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 |
| B、若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小 |
| C、铜极上的反应是2H++2e-═H2↑,O2+4e-+4H+═2H2O |
| D、在金属表面涂一层油脂,能防止铁铆钉被腐蚀 |
下列说法正确的是( )
| A、有化学键断裂的过程一定发生化学变化 | ||
| B、氯化钠是一种电解质,电解饱和食盐水可制得金属钠 | ||
C、将pH=a的醋酸稀释为pH=a+1的过程中,
| ||
| D、SiO2是酸性氧化物,能与强碱溶液反应,但不与任何酸反应 |
下列说法不正确的是( )
| A、服用铬含量超标的药用胶囊会对人对健康造成危害 |
| B、食用一定量的油脂能促进人体对某些维生素的吸收 |
| C、CH4和Cl2在光照条件下反应的产物最多可能有四种 |
| D、无论乙烯的加成,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关 |
下列说法不正确的是( )
| A、利用植物油的加成反应可以制得人造黄油 |
| B、75%的酒精可使蛋白质变性从而起到消毒作用 |
| C、纤维素在人体内可水解成葡萄糖,供人体组织的营养需要 |
D、可用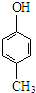 和HCHO为原料合成 和HCHO为原料合成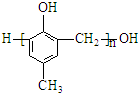 |