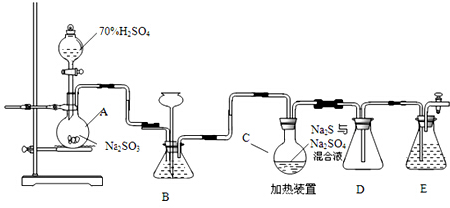
题目内容
设表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A、22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA |
| B、常温下,1L O.1mol/L NH4NO3的溶液中含氮原子数为0.2NA |
| C、室温下,21.Og乙烯和丁烯的混合气体中含有的碳原子数目为NA |
| D、含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.依据气体摩尔体积的条件应用分析判断;
B.根据n=cV、N=nNA、元素守恒判断;
C.根据烯烃的最简式计算出含有碳原子的物质的量;
D.根据Na2O与水反应生成氢氧化钠消耗水,所得溶液的体积小于1L判断.
B.根据n=cV、N=nNA、元素守恒判断;
C.根据烯烃的最简式计算出含有碳原子的物质的量;
D.根据Na2O与水反应生成氢氧化钠消耗水,所得溶液的体积小于1L判断.
解答:
解:A.温度和压强未知,22.4LCl2的物质的量不一定是1mol,故A错误;
B.1mol硝酸铵中有2mol氮原子,1L O.1mol/L NH4NO3的溶液中含硝酸铵0.1mol,故氮原子数为0.2NA,故B正确;
C.乙烯和丁烯的最简式为CH2,21g烯烃含有1.5mol最简式CH2,含有的碳原子数目为1.5NA,故C错误;
D.含NA个Na+的Na2O与水反应生成氢氧化钠1mol,消耗水则所得溶液的体积小于1L,Na+的物质的量浓度大于1mol/L,故D错误;
故选B.
B.1mol硝酸铵中有2mol氮原子,1L O.1mol/L NH4NO3的溶液中含硝酸铵0.1mol,故氮原子数为0.2NA,故B正确;
C.乙烯和丁烯的最简式为CH2,21g烯烃含有1.5mol最简式CH2,含有的碳原子数目为1.5NA,故C错误;
D.含NA个Na+的Na2O与水反应生成氢氧化钠1mol,消耗水则所得溶液的体积小于1L,Na+的物质的量浓度大于1mol/L,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的条件应用,主要考查气体摩尔体积的条件应用,有关物质的量的计算,氧化还原反应的电子转移的计算判断.

练习册系列答案
相关题目
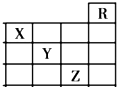 如图是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述正确的是( )①X的气态氢化物与Y最高价氧化物对应的水化物能发生反应生成盐
②等物质的量浓度的X、Y、Z的气态氢化物的水溶液的pH:X>Y>Z
③Z的单质常温下是液体,一定条件下可与铁粉反应
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
| A、只有③ | B、只有①④ |
| C、只有①②③④ | D、①②③④⑤ |
X、Y、Z、W、R 5种短周期元素,其原子序数依次增大.X是元素周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )
| A、Z与Y两种元素组成的化合物中,阴、阳离子个数比为1:1或1:2 |
| B、Y、Z、W元素形成的简单离子具有相同电子层结构,其离子半径依次增大 |
| C、Z、R元素的氧化物的水化物之间相互反应生成的盐溶液呈中性、碱性或酸性 |
| D、Y、R元素分别与X元素形成的化合物的沸点:XmY<XmR |
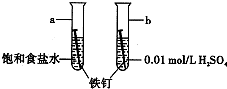 如图是研究铁钉腐蚀的装置图.下列说法不正确的是( )
如图是研究铁钉腐蚀的装置图.下列说法不正确的是( )| A、ab在两处的腐蚀速率a<b |
| B、a、b两处铁钉中的碳均为正极 |
| C、a、b两处铁钉中的铁均失电子被氧化 |
| D、a、b两处的正极反应式均为O2+4e-+4H+═2H2O |
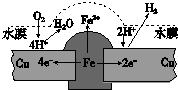 铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图.下列说法不正确的是( )
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图.下列说法不正确的是( )| A、因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 |
| B、若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小 |
| C、铜极上的反应是2H++2e-═H2↑,O2+4e-+4H+═2H2O |
| D、在金属表面涂一层油脂,能防止铁铆钉被腐蚀 |
下列说法正确的是( )
| A、有化学键断裂的过程一定发生化学变化 | ||
| B、氯化钠是一种电解质,电解饱和食盐水可制得金属钠 | ||
C、将pH=a的醋酸稀释为pH=a+1的过程中,
| ||
| D、SiO2是酸性氧化物,能与强碱溶液反应,但不与任何酸反应 |
短周期元素X、Y、Z、W的原子序数依次增大.X是原子半径最小的元素;Y原子最外层电子数是次外层的3倍;Z与X处于同一主族,W的原子序数是Y的2倍.下列叙述正确的是( )
| A、原子半径的大小顺序:W>Z>Y>X |
| B、化合物Z2Y2与X2Y反应时,Z2Y2既是氧化剂又是还原剂 |
| C、元素Y的简单气态氢化物的热稳定性比W的弱 |
| D、由X、Y、Z、W四种元素组成的化合物对水的电离平衡一定是促进的 |