题目内容
下列变化中不需要破坏化学键的是( )
| A、加热氯化铵 |
| B、干冰气化 |
| C、熔融氯化钠导电 |
| D、氯化氢溶于水 |
考点:化学键
专题:
分析:变化中不需要破坏化学键,说明没有发生化学反应或不发生电解质的电离,据此分析解答.
解答:
解:A.加热NH4Cl,发生反应NH4Cl
HCl↑+NH3↑,所以有化学键的破坏和形成,故A错误;
B.干冰气化只是物质状态发生变化,属于物理变化,所以没有化学键破坏,故B正确;
C.熔融NaCl导电,NaCl在熔融状态下电离出自由移动的阴阳离子而导电,所以有化学键的破坏,故C错误;
D.HCl溶于水,HCl在水分子的作用下电离出阴阳离子,所以有化学键的破坏,故D错误;
故选B.
| ||
B.干冰气化只是物质状态发生变化,属于物理变化,所以没有化学键破坏,故B正确;
C.熔融NaCl导电,NaCl在熔融状态下电离出自由移动的阴阳离子而导电,所以有化学键的破坏,故C错误;
D.HCl溶于水,HCl在水分子的作用下电离出阴阳离子,所以有化学键的破坏,故D错误;
故选B.
点评:本题考查化学键是否被破坏,明确哪些情况发生化学键的破坏是解本题关键,注意电解质的电离只发生化学键的断裂不发生化学键的形成,为易错点.

练习册系列答案
相关题目
在下列物质中,化合物类型相同的一组是( )
| A、NaCl HCl |
| B、CO2 H2O |
| C、H2CO3 KCl |
| D、MgCl2 SO2 |
在甲酸的下列性质中,可以证明它是弱电解质的是( )
| A、1mol/L甲酸溶液中c(H+)约为1×10-2mol/L |
| B、甲酸能与水以任意比互溶 |
| C、10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 |
| D、甲酸的导电性比强酸溶液的导电性弱 |
已知反应:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol,
②稀溶液中,H+(aq)+OH-(aq)=H2O;△H=-57.3kJ/mol下列结论正确的是( )
②稀溶液中,H+(aq)+OH-(aq)=H2O;△H=-57.3kJ/mol下列结论正确的是( )
| A、碳的燃烧热大于110.5 kJ/mol |
| B、①的反应热为221 kJ/mol |
| C、稀硫酸与稀NaOH溶液反应的中和热为114.6 kJ/mol |
| D、稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3 kJ热量 |
下列物质的水溶液能导电,但属于非电解质的是( )
| A、Na2S |
| B、Cl2 |
| C、NaHCO3 |
| D、CO2 |
下列解释事实的离子方程式不正确的是( )
| A、Fe能溶于FeCl3溶液:Fe+Fe3+═2Fe2+ |
| B、Cl2的氧化性强于Br2:Cl2+2Br-═2Cl-+Br2 |
| C、Na与H2O反应产生气体:2Na+2H2O═2Na++2OH-+H2↑ |
| D、Na2SiO3溶液与盐酸反应生成硅酸凝胶:SiO32-+2H+═H2SiO3(胶体) |
下列关于胶体的叙述不正确的是( )
| A、红色激光束能透过小烧杯中的氢氧化铁胶体,但不能透过小烧杯中较浓的硫酸铜溶液 |
| B、胶体的丁达尔效应是胶体粒子对可见光散射而形成的 |
| C、胶体化学是随20世纪未纳米科技兴起而产生的 |
| D、纳米粒子的大小与胶体粒子相当,但纳米粒子的体系不一定是胶体 |
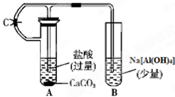 根据如图所示装置,请回答:
根据如图所示装置,请回答: