题目内容
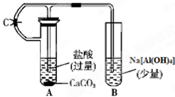 根据如图所示装置,请回答:
根据如图所示装置,请回答:(1)在A中加试剂后,立即打开止水夹C,B中的现象是
(2)一段时间后,关闭止水夹C,B中的现象是
考点:离子方程式的书写,钠的重要化合物
专题:
分析:(1)二氧化碳与偏铝酸钠反应生成氢氧化铝沉淀,据此写出B中反应现象及离子方程式;
(2)关闭止水夹C,A管中盐酸进入B试管中与氢氧化铝反应.
(2)关闭止水夹C,A管中盐酸进入B试管中与氢氧化铝反应.
解答:
解:(1)在A中加试剂后,立即打开止水夹C,A中生成的二氧化碳气体加入试管B,偏铝酸钠溶液与二氧化碳反应生成氢氧化铝沉淀,反应的离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,所以B中导管口有气泡冒出,有白色沉淀生成,
故答案为:导管口有气泡冒出,有白色沉淀生成;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(2)关闭止水夹C,A中气体压强增大,使A管中盐酸进入B试管中与氢氧化铝反应,氢氧化铝白色沉淀逐渐溶解,其反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:A中液体进入B中,液面上升,白色沉淀逐渐溶解;Al(OH)3+3H+=Al3++3H2O.
故答案为:导管口有气泡冒出,有白色沉淀生成;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(2)关闭止水夹C,A中气体压强增大,使A管中盐酸进入B试管中与氢氧化铝反应,氢氧化铝白色沉淀逐渐溶解,其反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:A中液体进入B中,液面上升,白色沉淀逐渐溶解;Al(OH)3+3H+=Al3++3H2O.
点评:本题考查了铝的混合物性质、离子方程式书写,题目难度中等,注意掌握常见元素单质及其化合物性质,明确离子方程式的书写原则,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
NA为阿伏加德罗常数,下述正确的是( )
| A、80g硝酸铵(NH4NO3)含有氮原子数为2NA |
| B、1L1mol?L-1的盐酸溶液中,所含氯化氢分子数为NA |
| C、标准状况下,11.2L酒精(C2H5OH)所含分子数为0.5NA |
| D、在钠与氯气的反应中,1mol钠失去的电子数为2 NA |
下列变化中不需要破坏化学键的是( )
| A、加热氯化铵 |
| B、干冰气化 |
| C、熔融氯化钠导电 |
| D、氯化氢溶于水 |
下列各方程式中,电离方程式书或水解反应正确的是( )
| A、H2CO3?2H++CO32- |
| B、NH4++2H2O?NH3?H2O+H3O + |
| C、CO2+H2O?HCO3-+H+ |
| D、CH3COONH4?CH3COO-+NH4+ |
胶体区别于其它分散系最本质的特征是( )
| A、外观透明 |
| B、有丁达尔效应 |
| C、不稳定 |
| D、分散质粒子直径为:10-9m~10-7m |
下列说法正确的是( )
| A、H2O分子和NH3分子具有相同数目的质子总数,故属于同种元素 | ||
| B、18O和16O互为同位素 | ||
| C、H218O和H216O属于同素异形体 | ||
D、对人体有害的氡的放射性同位素
|