题目内容
4.下列有关氨气的实验中,正确的是( )| A. |  制NH3 | B. |  干燥NH3 | C. |  收集NH3 | D. |  吸收NH3 |
分析 A.固体和固体加热制备气体需要试管口略向下倾斜;
B.氯化钙和氨气能发生反应生成络合物;
C.氨气是极性分子不溶于煤油;
D.氨气极易溶于水发生倒吸;
解答 解:A.装置图中加热生成的水倒流易引起试管炸裂,大试管口应略向下倾斜,故A错误;
B.干燥氨气不能用氯化钙干燥,应用碱石灰干燥,故B错误;
C.氨气不溶于煤油可以用排液法收集,故C正确;
D.氨气极易溶于水,装置图中导管直接插入水中易引发倒吸,故D错误;
故选C.
点评 本题考查了实验室氨气的制备方法和收集、干燥操作,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
15.①溴水 ②氯水 ③碘酒 ④氯化钾 ⑤酸性高锰酸钾溶液.能使湿润的淀粉KI试纸变蓝的是( )
| A. | ①②③ | B. | ①⑤ | C. | ①②③⑤ | D. | ③④⑤ |
12.设NA为阿伏伽德罗常数值,下列叙述不正确的是( )
| A. | 淀粉可用于酿酒 | |
| B. | 13g苯中含C-H键的数目是NA | |
| C. | 1mol的金刚石中含4NA根C-C键 | |
| D. | 标准状况下,11.2L甲烷和乙烯的混合物含氢原子数是2NA |
19.下列与生活密切相关的说法中不正确的是( )
| 选项 | A | B | C | D |
| 图片 |  |  |  |  |
| 生活中的应用 | 食品包装袋放有小袋铁粉 | 红酒中添加规定量的 SO2 | 饼干包装盒内放有小袋硅胶 | 口服补血剂(琥珀酸亚铁)并同时服维生素 C |
| 作用 | 铁粉有抗氧化 的作用 | SO2有漂白性的作用 | 硅胶有吸水的作 用 | 维生素 C 有防止 Fe2+被 氧化的作用 |
| A. | A | B. | B | C. | C | D. | D |
9.已知某烃A相对氢气的密度为35,且该烃不能使溴的四氯化碳溶液褪色,则A的可能结构共有(不考虑立体异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
16.下列有关化学用语表示正确的是( )
| A. | Al3+的结构示意图: | |
| B. | HC1O的电子式: | |
| C. | 中子数为117、质子数为116的Lv原子:${\;}_{116}^{117}$Lv | |
| D. | HOCH2COOH 缩聚物的结构简式: |
13.亚硝酸酰(Cl一N=O)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g)=2ClNO(g).
(l)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝既板,涉及如下反应:
①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H1 K1
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)△H2 K2
③2NO(g)+Cl2(g)?2ClNO(g)△H2 K3
△H3与△H3、△H2之间的关系式为△H3=2△H1-△H3;平衡常数K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$(用K1、K2表示).
(2)已知几种化学键的键能数据如表:
则:△H3+2a=289KJ/mol.
(3)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与t的关系如图A所示.
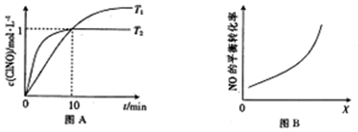
①反应开始到10min时,平均反应速率v(Cl2)=0.05mol/(L•min);
②T2时该反应的平衡常数K=2.
③NO的平衡转化率为50%.
(4)在密闭容器中充入NO(g)和Cl2(g),改变外界条件[压强、n(Cl2)/n(NO)、催化剂接触面],NO的平衡转化率变化如图B所示.X代表压强、$\frac{n(C{l}_{2})}{n(NO)}$.
(l)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝既板,涉及如下反应:
①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H1 K1
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)△H2 K2
③2NO(g)+Cl2(g)?2ClNO(g)△H2 K3
△H3与△H3、△H2之间的关系式为△H3=2△H1-△H3;平衡常数K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$(用K1、K2表示).
(2)已知几种化学键的键能数据如表:
| 化学键 | NO中氮氧键 | Cl-Cl键 | Cl-N键 | N=O键 |
| 键能/KJ/mol | 630 | 243 | a | 607 |
(3)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与t的关系如图A所示.

①反应开始到10min时,平均反应速率v(Cl2)=0.05mol/(L•min);
②T2时该反应的平衡常数K=2.
③NO的平衡转化率为50%.
(4)在密闭容器中充入NO(g)和Cl2(g),改变外界条件[压强、n(Cl2)/n(NO)、催化剂接触面],NO的平衡转化率变化如图B所示.X代表压强、$\frac{n(C{l}_{2})}{n(NO)}$.
15. 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
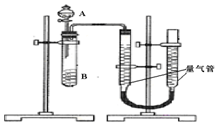
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
(1)该反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)实验开始前需要检查气密性.分液漏斗中A溶液应该一次性加入(填“一次性”或“逐滴滴加”)
(3)完成该实验还需要秒表(或计时器)(填仪器名称),实验结束后读数前需要移动量气管,使两个量气管的液面相平.
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
(4)X=5,4号实验中始终没有观察到溶液褪色,你认为可能的原因是KMnO4过量.
(5)2号反应中,H2C2O4的反应速率为0.00625mol/(L•s).
(6)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,
溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
结合实验目的与表中数据,你得出的结论是温度不是反应速率突然加快的原因.
(7)从影响化学反应速率的因素看,你的猜想还可能是催化剂的影响.若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是D(填字母).
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰.
 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
| 序号 | A溶液 | B溶液 |
| ① | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
| ② | 2mL0.1mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
| ③ | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液和少量MnSO4 |
(2)实验开始前需要检查气密性.分液漏斗中A溶液应该一次性加入(填“一次性”或“逐滴滴加”)
(3)完成该实验还需要秒表(或计时器)(填仪器名称),实验结束后读数前需要移动量气管,使两个量气管的液面相平.
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
(5)2号反应中,H2C2O4的反应速率为0.00625mol/(L•s).
(6)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,
溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
| 时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
(7)从影响化学反应速率的因素看,你的猜想还可能是催化剂的影响.若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是D(填字母).
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰.
