题目内容
2.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.请推断后回答下列问题:(1)Z在Y单质中燃烧的产物电子式为
 ,其中含有的化学键类型为离子键、共价键.
,其中含有的化学键类型为离子键、共价键.(2)Y、Z、W、R形成的简单离子半径由大到小顺序为S2->O2->Na+>Al3+.
(3)W单质与Z的高价氧化物对应的水化物反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,则X为H元素;Y原子最外层电子数是次外层电子数的3倍,由于最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故Y为O元素;R与Y处于同一族,则R为S元素;Z、W、R处于同一周期,即处于第三周期,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,即Z、W原子核外电子数之和为24,故Z为Na,W为Al.
解答 解:X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,则X为H元素;Y原子最外层电子数是次外层电子数的3倍,由于最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故Y为O元素;R与Y处于同一族,则R为S元素;Z、W、R处于同一周期,即处于第三周期,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,即Z、W原子核外电子数之和为24,故Z为Na,W为Al.
(1)钠在氧气中燃烧的产物为Na2O2,电子式为 ,含有的化学键类型为离子键、共价键,
,含有的化学键类型为离子键、共价键,
故答案为: ;离子键、共价键;
;离子键、共价键;
(2)Y、Z、W、R形成的简单离子分别为O2-、Na+、Al3+、S2-,电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->O2->Na+>Al3+,
故答案为:S2->O2->Na+>Al3+;
(3)W单质为Al,与Z的高价氧化物对应的水化物为NaOH,而反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查结构性质位置关系应用,关键是根据原子结构推断元素,掌握微粒半径比较规律,熟练掌握元素化合物知识,有利于基础知识的巩固.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
固体1质量为11g,沉淀1质量为23.3g,沉淀2质量为6g,红褐色固体质量为8g.则下列说法正确的是( )
| A. | 溶液1加入KSCN溶液一定呈红色 | |
| B. | 取少量溶液2加入酸化的硝酸银溶液,生成白色沉淀,则甲中一定有NaCl | |
| C. | 固体1与稀盐酸反应时还生成了标准状况下气体1.12L | |
| D. | 沉淀2不溶于任何酸溶液 |
| A. | NaOH+HCl→NaCl+H2O | B. | 2NaOH+H2SO4→Na2SO4+2H2O | ||
| C. | Ba(OH)2+H2SO4→BaSO4↓+2H2O | D. | Ba(OH)2+2HCl→BaCl2+2H2O |

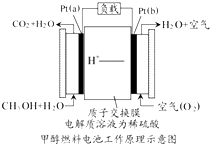 科学家预言,燃料电池将是21世纪获得电能的重要途径,近几年开发甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过,其工作原理的示意图如下:
科学家预言,燃料电池将是21世纪获得电能的重要途径,近几年开发甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过,其工作原理的示意图如下: