题目内容
7.用离子方程式表示怎样用化学方法除去下列物质中混有的少量杂质.(1)CuO中混有少量Al2O3Al2O3+2OH-=AlO2-+2H2O
(2)FeCl3溶液中混有少量FeCl2溶液.2Fe2++Cl2=2Cl-+2Fe3+.
分析 (1)氧化铝与氢氧化钠溶液反应生成可溶性偏铝酸钠溶液,氧化铁不反应;
(2)氯化亚铁与氯气反应生成氯化铁.
解答 解:(1)氧化铝与氢氧化钠溶液反应生成可溶性偏铝酸钠溶液,离子方程式:Al2O3+2OH-=AlO2-+2H2O,氧化铁不反应,过滤反应后混合物可以分离氧化铁;
故答案为:Al2O3+2OH-=AlO2-+2H2O;
(2)氯化亚铁与氯气反应生成氯化铁,离子方程式:2Fe2++Cl2=2Cl-+2Fe3+,故答案为:2Fe2++Cl2=2Cl-+2Fe3+.
点评 本题考查了物质的提纯,为高频考点,侧重考查离子方程式的书写,明确物质的性质及发生的反应是解题关键,注意除杂不能引入新杂质,题目难度中等.

练习册系列答案
相关题目
17.下列有关实验原理或实验操作不正确的是( )
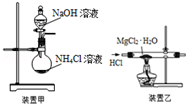

| A. | 焰色反应实验时,在蘸取待测液前,先用稀盐酸洗净铂丝并灼烧至无色 | |
| B. | 使用分液漏斗和容量瓶时,首先要查是否漏水 | |
| C. | 实验室用装置甲制取NH3 | |
| D. | 用装置乙制取无水MgCl2 |
18.下列说法不正确是( )
| A. | 沸点由高到低的排列顺序:HF>HI>HBr>HCl | |
| B. | PCl3和BF3分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | H2O是极性分子,分子中O原子不处在2个H原子所连直线的中央 | |
| D. | 离子晶体可含有极性共价键,也可含有非极性共价键 |
15.“鸟巢”被评为2008年世界最具影响力的十大建筑之一.合金钢Q460是支撑“鸟巢”的铁骨钢筋,除含有铁元素外,还含有Mn(锰)、Ti(钛)、Cr(铬)、Nb(铌)等元素.下列有关说法正确的是( )
| A. | Fe位于元素周期表的第四周期ⅧB族 | |
| B. | ${\;}_{22}^{46}$TiO2、${\;}_{22}^{48}$TiO2、${\;}_{22}^{50}$TiO2互为同位素 | |
| C. | 工业上利用热还原法冶炼金属Fe | |
| D. | ${\;}_{41}^{92}Nb$3+原子核内有51个中子,核外有41个电子 |
12.10℃时加热饱和NaHCO3溶液,测得该溶液的pH发生如表所示的变化.
甲同学认为,该溶液pH增大的原因是HCO3-的水解程度增大,故碱性增强,有关反应的离子方程式为HCO3-+H2O?H2CO3+OH-.乙同学认为,溶液pH增大的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度大于(填“大于”或“小于”)NaHCO3的水解程度,该分解反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.丙同学认为,甲、乙的判断都不充分,他进行如下探究来验证他们的判断是否正确.
(1)在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)的判断正确,试剂X是B(填序号).
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH=8.3,则甲(填“甲”或“乙”)的判断正确.
| 温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)的判断正确,试剂X是B(填序号).
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH=8.3,则甲(填“甲”或“乙”)的判断正确.
19.50g碳在空气中燃烧,得到等体积的CO和CO2,已知:C(s)+$\frac{1}{2}{O}_{2}$(g)═CO(g)△H=-110.35kJ•mol-1,CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.57kJ•mol-1.损失的能量与实际放出的能量之比大约是( )
| A. | 283:503 | B. | 55:141 | C. | 141:196 | D. | 1:1 |
16.某化学兴趣小组在课外活动中,对某溶液进行了多次检验,其中三次检验结果如下表所示,请回答下列问题.
(1)三次检验结果中第二次检验结果不正确.
(2)为了确定NH4+的存在,写出鉴定NH4+的实验方法和现象:取原溶液少许,加入浓NaOH溶液,微热,产生的气体能使湿润石蕊的红色石蕊试纸变蓝.
| 检验次数 | 溶液中检验出的物质 |
| 第一次 | KCl、K2SO4、Na2CO3、NH4Cl |
| 第二次 | NH4Cl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、NH4Cl、K2CO3、NaCl |
(2)为了确定NH4+的存在,写出鉴定NH4+的实验方法和现象:取原溶液少许,加入浓NaOH溶液,微热,产生的气体能使湿润石蕊的红色石蕊试纸变蓝.
17.下列表示式中,正确的是( )
| A. | 醋酸的电离方程式:CH3COOH→CH3COO一+H+ | |
| B. | 常温下NH4Cl溶液的pH<7 | |
| C. | 因为SO3的水溶液能够导电,所以SO3是强电解质 | |
| D. | 在常温下的NaOH溶液中,由于NaOH抑制了水的电离,水的离子积常数(KW)减小 |
 ,其中含有的化学键类型为离子键、共价键.
,其中含有的化学键类型为离子键、共价键.