题目内容
12.某无色溶液里,只含有下列八种离子中的某几种:Mg2+、Na+、H+、Ag+、Cl-、$HCO_3^-、O{H^-}、NO_3^-$.已知该溶液能跟金属铝反应,且放出的气体只有氢气,试回答:(1)若溶液跟Al反应后有[Al(OH)4]-生成,则原溶液一定含有大量的Na+、OH-离子,还可能含有大量的NO3-、Cl-离子.
(2)若溶液跟Al反应后有Al3+生成,则原溶液中一定不含有大量Ag+、OH-、HCO3-、NO3-离子.
分析 跟金属铝反应生成H2的溶液可能为酸溶液,也可能为碱溶液,当生成Al3+时,溶液为酸溶液,当生成[Al(OH)4]-时,溶液为碱溶液,然后利用离子的共存的条件进行解答.
解答 解:离子均为无色,所有离子均与无色透明溶液符合;铝既能与酸作用产生氢气,也能与碱作用产生氢气,
(1)溶液和铝粉反应后有[Al(OH)4]-生成,溶液显碱性,Mg2+、H+、Ag+、HCO3-不能存在,根据溶液不显电性,一定存在阳离子,即阳离子只有Na+,说明原溶液中的阴离子一定含OH-,可能含NO3-、Cl-,
故答案为:Na+、OH-;NO3-、Cl-;
(2)溶液和铝粉反应后有Al3+生成,溶液显酸性,则HCO3-、OH-不存在,由于硝酸与金属反应一般没有氢气产生,因此也不存在NO3-,根据溶液不显电性,一定存在阴离子,即溶液中肯定有Cl-,而Ag+可与Cl-生成沉淀,说明原溶液中也不存在Ag+,即溶液中一定含有大量的H+、Cl-,可能含Na+、Mg2+,一定不能含有的离子为:Ag+、OH-、HCO3-、NO3-,
故答案为:Ag+、OH-、HCO3-、NO3-.
点评 本题考查物质的检验及离子的共存问题,明确常见离子之间的反应是解答本题的关键,并注意利用溶液为电中性、溶液的酸碱性等来分析解答即可,题目难度不大.

练习册系列答案
相关题目
20.下列变化一定属于化学变化的是( )
①煤的液化;②变色;③煤的干馏;④爆炸;⑤白磷转变成红磷;⑥工业制氧气;⑦久置氯水变成无色;⑧分馏;⑨NO2气体冷却后颜色变浅;⑩潮解.
①煤的液化;②变色;③煤的干馏;④爆炸;⑤白磷转变成红磷;⑥工业制氧气;⑦久置氯水变成无色;⑧分馏;⑨NO2气体冷却后颜色变浅;⑩潮解.
| A. | ①②③④⑦ | B. | ③④⑤⑦⑨ | C. | ①③⑤⑦⑨ | D. | ①③④⑦⑩ |
7.为证明化学反应有一定的限度,进行如下探究活动:
I.取5mL 0.1mol/L的KI溶液,滴加5-6滴FeCl3稀溶液;
Ⅱ.继续加入2mL CCl4,盖好玻璃塞,振荡静置.
Ⅲ.取少量分液后得到的上层清液,滴加KSCN溶液.
Ⅳ.移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点.重复滴定三次,平均耗用c mol/LKI标准溶液VmL.
(1)探究活动I中发生反应的离子方程式为2Fe3++2I-=2Fe2++I2 .
请将探究活动Ⅱ中“振荡静置”后得到下层液体的操作补充完整:将分液漏斗放在铁架台上,静置.
待液体分层后,将分液漏斗颈上的玻璃塞打开,或使玻璃塞上的凹槽(或小孔)对准分液漏斗上的小孔,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下.
(2)探究活动Ⅲ的意图是通过生成红色的溶液(假设溶质全部为Fe(SCN)3),验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,密度为0.71g/mL,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4-反应生成暗蓝色沉淀,用K4[Fe(CN)6](亚铁氰化钾)溶液检验Fe3+的灵敏度比用KSCN溶液更高.
结合新信息,现设计以下实验方案验证猜想:
①请完成如表
②写出实验操作“步骤一”中的反应离子方程式:4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓.
(3)根据探究活动Ⅳ,FeCl3稀溶液物质的量浓度为0.04cVmol/L.
I.取5mL 0.1mol/L的KI溶液,滴加5-6滴FeCl3稀溶液;
Ⅱ.继续加入2mL CCl4,盖好玻璃塞,振荡静置.
Ⅲ.取少量分液后得到的上层清液,滴加KSCN溶液.
Ⅳ.移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点.重复滴定三次,平均耗用c mol/LKI标准溶液VmL.
(1)探究活动I中发生反应的离子方程式为2Fe3++2I-=2Fe2++I2 .
请将探究活动Ⅱ中“振荡静置”后得到下层液体的操作补充完整:将分液漏斗放在铁架台上,静置.
待液体分层后,将分液漏斗颈上的玻璃塞打开,或使玻璃塞上的凹槽(或小孔)对准分液漏斗上的小孔,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下.
(2)探究活动Ⅲ的意图是通过生成红色的溶液(假设溶质全部为Fe(SCN)3),验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,密度为0.71g/mL,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4-反应生成暗蓝色沉淀,用K4[Fe(CN)6](亚铁氰化钾)溶液检验Fe3+的灵敏度比用KSCN溶液更高.
结合新信息,现设计以下实验方案验证猜想:
①请完成如表
| 实验操作 | 现象和结论 |
| 步骤一:取萃取后得到的上层清液,加入2滴K4[Fe(CN)6](亚铁氰化钾)溶液 | 若产生暗蓝色沉淀,则猜想一不成立. |
| 步骤二:取探究Ⅲ中所得溶液,加入少量乙醚,充分振荡,静置分层 | 若乙醚层呈红色,则猜想二成立. |
(3)根据探究活动Ⅳ,FeCl3稀溶液物质的量浓度为0.04cVmol/L.
17.下列有关实验原理或实验操作不正确的是( )
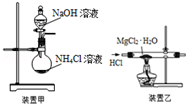

| A. | 焰色反应实验时,在蘸取待测液前,先用稀盐酸洗净铂丝并灼烧至无色 | |
| B. | 使用分液漏斗和容量瓶时,首先要查是否漏水 | |
| C. | 实验室用装置甲制取NH3 | |
| D. | 用装置乙制取无水MgCl2 |
4.在常温下,把一个盛有一定量甲烷和氯气的密闭玻璃容器放在光亮的地方,两种气体发生反应,下列叙述中不正确的是( )
| A. | 容器内原子总数不变 | B. | 容器内压强不变 | ||
| C. | 容器内分子总数不变 | D. | 发生的反应属于取代反应 |
1.表是A、B两种有机物的有关信息:
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2二溴乙烷.
(2)A与氢气发生加成反应后生成分子C,与C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是bc(填序号)
a.无色无味液体 b.有毒 c.不溶于水 d.密度比水大 e.能使酸性KMnO4溶液和溴水褪色 f.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: .
.
| A | B |
| ①能使溴的四氯化碳溶液褪色; ②比例模型:  ③能与水在一定条件下反应 | ①由C、H两种元素组成; ②球棍模型为  |
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2二溴乙烷.
(2)A与氢气发生加成反应后生成分子C,与C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是bc(填序号)
a.无色无味液体 b.有毒 c.不溶于水 d.密度比水大 e.能使酸性KMnO4溶液和溴水褪色 f.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
. 
 +H2O(R、R′为H或烃基)
+H2O(R、R′为H或烃基)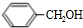 ;C中含有的官能团碳碳双键和醛基(写名称).
;C中含有的官能团碳碳双键和醛基(写名称). .
. .
.



 ;
; ;
; ;
; .
. ,其中含有的化学键类型为离子键、共价键.
,其中含有的化学键类型为离子键、共价键.