题目内容
同周期的X、Y、Z三元素,它们最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
| A、含氧酸的酸性H3ZO4>H2YO4>HXO4 |
| B、非金属性X>Y>Z |
| C、元素的负化合价的绝对值按X、Y、Z变小 |
| D、气态氢化物的稳定性按X、Y、Z的顺序增强 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:同周期的X、Y、Z三元素,它们最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则X、Y、Z的最高正化合价依次为+7、+6、+5,原子序数X>Y>Z,对应负化合价依次为-1、-2、-3,同周期随原子序数递增,元素非金属性增强、最高价含氧酸的酸性增强、氢化物稳定性增强.
解答:
解:同周期的X、Y、Z三元素,它们最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则X、Y、Z的最高正化合价依次为+7、+6、+5,原子序数X>Y>Z,同周期随原子序数递增,元素非金属性增强,故非金属性:X>Y>Z,
A.元素非金属性增强,最高价含氧酸的酸性增强,故酸性H3ZO4<H2YO4<HXO4,故A错误;
B.由上述分析可知,非金属性:X>Y>Z,故B正确;
C.X、Y、Z对应负化合价依次为-1、-2、-3,其绝对值依次增大,故C错误;
D.氢化物稳定性与元素非金属性一致,非金属性X>Y>Z,故氢化物稳定性按X、Y、Z的顺序递减,故D错误,
故选B.
A.元素非金属性增强,最高价含氧酸的酸性增强,故酸性H3ZO4<H2YO4<HXO4,故A错误;
B.由上述分析可知,非金属性:X>Y>Z,故B正确;
C.X、Y、Z对应负化合价依次为-1、-2、-3,其绝对值依次增大,故C错误;
D.氢化物稳定性与元素非金属性一致,非金属性X>Y>Z,故氢化物稳定性按X、Y、Z的顺序递减,故D错误,
故选B.
点评:本题考查性质与位置关系,侧重对元素周期律的考查,根据最高正化合价判断元素的位置关系,有利于基础知识的巩固,难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
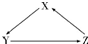 X、Y、Z为中学化学常见物质,其转化关系如下图所示(“→”表示一步转化).下列组合不正确的是( )
X、Y、Z为中学化学常见物质,其转化关系如下图所示(“→”表示一步转化).下列组合不正确的是( )| 选项 | X | Y | Z |
| A | SiO2 | H2SiO3 | Na2SiO3 |
| B | Na | Na2O2 | NaOH |
| C | H2SO3 | SO2 | H2SO4 |
| D | HClO | Cl2 | HCl |
| A、A | B、B | C、C | D、D |
设NA为阿伏加德罗常数的值,N表示粒子数.下列说法正确的是( )
| A、0.1 mol苯乙烯中含有碳碳双键的数目为0.4NA |
| B、将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2[NA-N(Cl2)] |
| C、一定条件下,0.1 mol SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
| D、电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4g |
下列各组物质中,化学键类型不同的是( )
| A、NaCl和HNO3 |
| B、H2O和NH3 |
| C、CaF2和CsCl |
| D、CCl4和HCl |
100mL 6mol?L-1的H2SO4跟过量的锌反应,在一定温度下,为减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A、硫酸钠固体 | B、水 |
| C、硫酸钾溶液 | D、硝酸钾溶液 |
在由Fe、FeO和Fe2O3组成的混合物中加入100mL2mol?L-1的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+离子.则下列判断正确的是( )
| A、混合物里三种物质反应时消耗盐酸的物质的量之比为1:1:3 |
| B、反应后所得溶液中的Fe2+离子与Cl-离子的物质的量之比为1:2 |
| C、混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量少 |
| D、混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |