题目内容
设NA为阿伏加德罗常数的值,N表示粒子数.下列说法正确的是( )
| A、0.1 mol苯乙烯中含有碳碳双键的数目为0.4NA |
| B、将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2[NA-N(Cl2)] |
| C、一定条件下,0.1 mol SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
| D、电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4g |
考点:阿伏加德罗常数
专题:
分析:A、苯不是单双键交替的结构;
B、根据氯原子的守恒来分析;
C、SO2与足量氧气反应生成SO3的反应为可逆反应,不能进行彻底;
D、电解精炼铜过程中,阳极粗铜中含有杂质铁、锌等,所以阳极质量减少6.4g时,转移的电子的物质的量不一定是0.2mol;
B、根据氯原子的守恒来分析;
C、SO2与足量氧气反应生成SO3的反应为可逆反应,不能进行彻底;
D、电解精炼铜过程中,阳极粗铜中含有杂质铁、锌等,所以阳极质量减少6.4g时,转移的电子的物质的量不一定是0.2mol;
解答:
解:A、苯不是单双键交替的结构,不含碳碳双键,故A错误;
B、1mol氯气中共含2mol氯原子,而氯气与水的反应为可逆反应,不能进行彻底,故溶液中有HClO分子、ClO-、Cl-、Cl2分子,根据氯原子的守恒可有:2NA=N(HClO)+N(Cl-)+N(ClO-)+2N(Cl2),即N(HClO)+N(Cl-)+N(ClO-)=2[NA-N(Cl2)],故B正确;
C、SO2与足量氧气反应生成SO3的反应为可逆反应,不能进行彻底,故转移电子数小于0.2NA,故C错误;
D、粗铜中含有杂质铁、锌等,所以阳极减少6.4g时,电路中转移的电子的物质的量不一定为0.2mol,转移的电子数不一定为0.2NA,故D错误;
故选B.
B、1mol氯气中共含2mol氯原子,而氯气与水的反应为可逆反应,不能进行彻底,故溶液中有HClO分子、ClO-、Cl-、Cl2分子,根据氯原子的守恒可有:2NA=N(HClO)+N(Cl-)+N(ClO-)+2N(Cl2),即N(HClO)+N(Cl-)+N(ClO-)=2[NA-N(Cl2)],故B正确;
C、SO2与足量氧气反应生成SO3的反应为可逆反应,不能进行彻底,故转移电子数小于0.2NA,故C错误;
D、粗铜中含有杂质铁、锌等,所以阳极减少6.4g时,电路中转移的电子的物质的量不一定为0.2mol,转移的电子数不一定为0.2NA,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
下列说法正确的是( )
| A、常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| C、在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| D、物质的溶解度随温度的升高而增加,物质的溶解都是吸热的 |
 水系锂电池具有安全、环保和价格低廉等优点成为当前电池研究领域的热点.以钒酸钠(NaV3O8)为正极材料的电极反应式为:NaV3O8+xLi++xe-=NaLixV3O8,则下列说法不正确的是( )
水系锂电池具有安全、环保和价格低廉等优点成为当前电池研究领域的热点.以钒酸钠(NaV3O8)为正极材料的电极反应式为:NaV3O8+xLi++xe-=NaLixV3O8,则下列说法不正确的是( )| A、放电时,负极的电极反应式:Li-e-═Li+ |
| B、充电过程中Li+从阳极向阴极迁移 |
| C、充电过程中阳极的电极反应式为NaLixV3O8-xe-=NaV3O8+xLi+,NaLixV3O8中钒的化合价发生变化 |
| D、该电池可以用硫酸钠溶液作电解质 |
下列关于氨分子的化学用语错误的是( )
| A、化学式:NH3 |
B、电子式: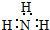 |
C、结构式: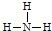 |
D、比例模型: |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | ||
| B、常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA | ||
| C、标准状况下,2.24L的CCl4中含有的C-Cl键数为0.4NA | ||
D、将CO2通过Na2O2使其增重a克时,反应中转移电子数为
|
下列反应的离子方程式正确的是( )
| A、钠和硫酸铜溶液反应:2Na+Cu2+=2Na++Cu |
| B、AlCl3溶液中加入足量的氨水制Al(OH)3:Al3++3OH-=Al(OH)3↓ |
| C、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D、二氧化硅溶于NaOH溶液:SiO2+2OH-=SiO32-+H2O |
同周期的X、Y、Z三元素,它们最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
| A、含氧酸的酸性H3ZO4>H2YO4>HXO4 |
| B、非金属性X>Y>Z |
| C、元素的负化合价的绝对值按X、Y、Z变小 |
| D、气态氢化物的稳定性按X、Y、Z的顺序增强 |