题目内容
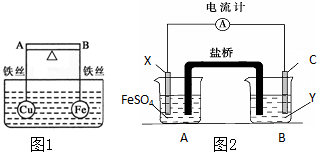 (1)如图1所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)当杠杆为绝缘体时,A端比B端
(1)如图1所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)当杠杆为绝缘体时,A端比B端(2)依据氧化还原反应:Fe+Cu2+=Fe2++Cu设计的原电池如图2所示,其中Y为可溶性硫酸盐.请回答下列问题:
①电解质溶液Y是
②X电极发生的电极反应为
③装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(3)把(2)中盐桥改为铁棒插入A、B池中,其它不变,电流计的指针
(4)把(2)中盐桥改为铜棒,其它不变,电流计的指针
考点:设计原电池,电解原理
专题:电化学专题
分析:(1)当杠杆为绝缘体时,铁和铜离子发生置换反应;当杠杆为导体时,该装置构成原电池,铁作负极,铜作正极;
(2)原电池中,失电子的金属作负极,不如负极活泼的金属或导电的非金属作正极,得电子的可溶性溶液为电解质溶液;原电池放电时,盐桥中阳离子向正极移动,阴离子向负极移动;
(3)把(2)中盐桥改为铁棒插入A、B池中,其它不变,B能构成原电池,A有外接电源,属于电解池,A中阳极材料和电解质溶液中金属阳离子为相同元素,所以为电镀池;
(4)把(2)中盐桥改为铜棒,其它不变,该装置不能自发的进行氧化还原反应,所以不能构成原电池.
(2)原电池中,失电子的金属作负极,不如负极活泼的金属或导电的非金属作正极,得电子的可溶性溶液为电解质溶液;原电池放电时,盐桥中阳离子向正极移动,阴离子向负极移动;
(3)把(2)中盐桥改为铁棒插入A、B池中,其它不变,B能构成原电池,A有外接电源,属于电解池,A中阳极材料和电解质溶液中金属阳离子为相同元素,所以为电镀池;
(4)把(2)中盐桥改为铜棒,其它不变,该装置不能自发的进行氧化还原反应,所以不能构成原电池.
解答:
解:(1)当杠杆为绝缘体时,铁和铜离子发生置换反应,所以铁球上析出铜导致质量增大,铜球质量不变,所以A端上升,B端下沉,即A端比B端高;
当杠杆为导体时,该装置构成原电池,铁作负极,铜作正极,负极上铁失电子发生氧化反应,正极上析出铜,所以B端上升,A端下沉,即A端比B端低,
故答案为:高;低;
(2)①含有盐桥的原电池中,电极材料与电解质溶液中金属阳离子为同种元素,X为铁,则Y为硫酸铜溶液,
故答案为:CuSO4;
②X电极为铁,铁易失电子而作负极,电极反应式为:Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+;
③盐桥中氯离子向负极电解质溶液移动,钾离子向正极电解质溶液移动,所以钾离子向右侧烧杯移动、Cl-向左侧烧杯移动,故选B;
(3)把(2)中盐桥改为铁棒插入A、B池中,其它不变,B能构成原电池,A有外接电源,属于电解池,所以该装置中有电流产生,A中阳极材料和电解质溶液中金属阳离子为相同元素,所以为电镀池,阳极上铁失电子生成亚铁离子,阴极上亚铁离子得电子生成铁,所以溶液浓度不变,右边装置中,铁易失电子作负极,铜作正极,
故答案为:会;电解池;不变;正极;
(4)把(2)中盐桥改为铜棒,其它不变,该装置不能自发的进行氧化还原反应,所以不能构成原电池,
故答案为:不会;两池都没有可自发进行的氧化还原反应.
当杠杆为导体时,该装置构成原电池,铁作负极,铜作正极,负极上铁失电子发生氧化反应,正极上析出铜,所以B端上升,A端下沉,即A端比B端低,
故答案为:高;低;
(2)①含有盐桥的原电池中,电极材料与电解质溶液中金属阳离子为同种元素,X为铁,则Y为硫酸铜溶液,
故答案为:CuSO4;
②X电极为铁,铁易失电子而作负极,电极反应式为:Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+;
③盐桥中氯离子向负极电解质溶液移动,钾离子向正极电解质溶液移动,所以钾离子向右侧烧杯移动、Cl-向左侧烧杯移动,故选B;
(3)把(2)中盐桥改为铁棒插入A、B池中,其它不变,B能构成原电池,A有外接电源,属于电解池,所以该装置中有电流产生,A中阳极材料和电解质溶液中金属阳离子为相同元素,所以为电镀池,阳极上铁失电子生成亚铁离子,阴极上亚铁离子得电子生成铁,所以溶液浓度不变,右边装置中,铁易失电子作负极,铜作正极,
故答案为:会;电解池;不变;正极;
(4)把(2)中盐桥改为铜棒,其它不变,该装置不能自发的进行氧化还原反应,所以不能构成原电池,
故答案为:不会;两池都没有可自发进行的氧化还原反应.
点评:本题以原电池和电解池原理为载体考查原电池的设计,根据电池反应式中得失电子的物质确定电极材料及电解质溶液,明确原电池的构成条件是解本题关键,难度中等.

练习册系列答案
相关题目
下列各组离子在强碱性溶液中可以大量共存的是( )
| A、Ca2+ K+ CO32- Cl- |
| B、H+ Fe2+ Cl- NO3- |
| C、Na+ Ba2+ NO3- Cl- |
| D、Na+ Al3+ NO3- Cl- |
对下列事故处理方法错误的是( )
| A、金属钠着火,立即用泡沫灭火器灭火 |
| B、洗发水流入眼内,立即用大量水冲洗 |
| C、不小心把250mL的小罐油漆引燃,立即用湿毛巾盖灭 |
| D、浓硫酸溅到皮肤上,立即用干净的布轻轻拭去,并用大量的水冲洗 |
下列水溶液显酸性的是( )
| A、硫酸钠溶液 | B、蔗糖溶液 |
| C、氯化铝溶液 | D、碳酸钠溶液 |
将Pt电极插入KOH溶液,然后分别向两极通入CH4和02,即可产生电流,称为甲烷燃料电池.下列叙述中正确的是( )
| A、放电时电流从通人CH4的电极流向通入02的电极 |
| B、放电时溶液中的阳离子向负极移动 |
| C、放电时正极的电极反应式为02+2H2O+4e-=40H- |
| D、放电时溶液的PH增大 |
