题目内容
14.合成氨工业对国民经济和社会发展具有重要的意义.其原理为:N2(g)+3H2(g)??2ΝΗ3(g)△H=-92.4kJ/mol,据此回答以下问题:(1)①该反应的化学平衡常数表达式为K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越小.
(2)某温度下,若把10mol N2与30mol H2置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=$\frac{1}{12}$(可用分数表示).能说明该反应达到化学平衡状态的是bd(填字母).
a.容器内的密度保持不变
b.容器内压强保持不变
c.v正(N2)=2v逆(NH3)
d.混合气体中c(NH3)不变
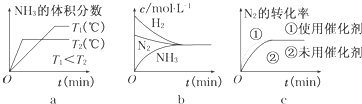
(3)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)ac.
分析 (1)①依据平衡常数概念和化学方程式书写平衡常数表达式,用生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;
②反应是放热反应,升高温度后平衡逆向进行,平衡常数减小;
(2)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;平衡标志是正逆反应速率相同,各组分含量保持不变分析选项;
(3)a.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动;
b.平衡时浓度不一定相等;
c.使用催化剂加快反应速率,对平衡无影响.
解答 解:(1)①K为生成物浓度幂之积与反应物浓度幂之积的比,则该反应的平衡常数为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;
②该反应为放热反应,升高温度,平衡逆向移动,则平衡常数K减小,温度越高,K越小,故答案为:小;
(2)设氮气消耗物质的量为x
N2(g)+3H2(g)?2NH3(g)
开始 1 3 0
转化 x 3x 2x
平衡1-x 3-3x 2x
平衡混合气体中氨的体积分数为20%,$\frac{2x}{1-x+3-3x+2x}$×100%=20%,
解得:x=$\frac{1}{3}$,平衡常数K=$\frac{({\frac{2}{3})}^{2}}{(1-\frac{1}{3})×(3-3×\frac{1}{3})^{3}}$=$\frac{1}{12}$,
由平衡的特征“等”、“定”可判定平衡,则:
a.容器的体积、气体的质量始终不变,则容器内的密度保持不变,不能判断平衡,故a错误;
b.该反应为反应前后体积不等的反应,则容器内压强保持不变,达到平衡,故b正确;
c.υ正(N2)=2υ逆(NH3),正逆反应速率不等,反应没有达到平衡,故c错误;
d.混合气体中 c(NH3)不变,为平衡的特征,达到平衡,故d正确;
故答案为:$\frac{1}{12}$;bd;
(3)a.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动,与图象一致,故a正确;
b.平衡时浓度不一定相等,平衡浓度取决起始浓度和转化率,图象表示错误,故b错误;
c.使用催化剂加快反应速率,对平衡无影响,平衡时物质的浓度不变,与图象一致,故c正确;
故答案为:ac.
点评 本题考查化学平衡的计算、影响反应速率及平衡的因素、化学平衡状态判断,化学平衡图象等知识,题目难度中等,注重高考常考查点的考查,明确化学平衡状态特征及其影响因素为解答关键,注意掌握化学平衡常数的概念及计算方法.

 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案| A. | 观察钠的焰色反应需透过蓝色钴玻璃 | |
| B. | 实验室中的各种碱金属单质均保存在煤油中 | |
| C. | 配制一定物质的量浓度的溶液时容量瓶中有少量水不影响实验 | |
| D. |  为提醒人们在使用浓H2SO4时要注意安全,贮存浓H2SO4的容器上贴有图标识 |
| A. | 5.68g | B. | 7.1g | C. | 3.55g | D. | 1.42g |
①酸性氧化物不一定是非金属氧化物
②不能跟酸反应的氧化物一定能跟碱反应
③碱性氧化物肯定是金属氧化物
④乙酸乙酯在碱性条件下水解称为取代反应或者皂化反应
⑤浊液均可用过滤的方法分离.
| A. | ①③④ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
| A. | 25.5g | B. | 39g | C. | 51g | D. | 106.5g |
| A. | CuSO4水溶液 | B. | 银氨溶液 | C. | 硫氰化铁溶液 | D. | I2的CCl4溶液 |
| A. | 液态氢氧化钾 | B. | 液态氯化氢 | C. | 氯化钠溶液 | D. | 碳棒 |
| A. | 65:(A-65) | B. | 64:(A-65) | C. | 65:(A-64) | D. | 64:(A-64) |