题目内容
14.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )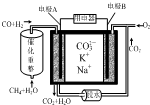
| A. | 电极A为正极,发生了还原反应 | |
| B. | 电极A上CO参与的电极反应为:CO+O2--2e-═CO2 | |
| C. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- | |
| D. | 电池工作时,K+向电极A移动 |
分析 原电池工作时,CO和H2失电子在负极反应,则A为负极,CO和H2被氧化生成二氧化碳和水,正极B上为氧气得电子生成CO32-,以此解答该题.
解答 解:A.A为负极,负极上CO和H2失电子发生了氧化反应,故A错误;
B.负极上CO和H2被氧化生成二氧化碳和水,电极A反应为:H2+CO+2CO32--4e-=H2O+3CO2,故B错误;
C.B为正极,正极为氧气得电子生成CO32-,反应为O2+2CO2+4e-=2CO32-,故C正确;
D.电池工作时,阳离子向正极移动,即K+向电极B移动,故D错误.
故选C.
点评 本题考查了化学电源新型电池,明确原电池中物质得失电子、电子流向、离子流向即可解答,难点是电极反应式书写,要根据电解质确定正负极产物,难度中等.

练习册系列答案
相关题目
4.雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:
2NO(g)+2CO$?_{加热}^{催化剂}$2CO2(g)+N2(g)△H<O
①该反应的速率时间罔像如图中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图中右图所示.以下说法正确的是BC(填对应字母).
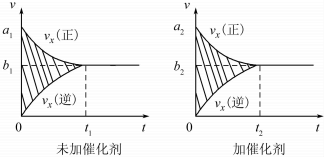
A.a1>a2,B.b1<b2 C.t1>t2 D.右图中阴影部分面积更大 E.左图中阴影部分面积更大
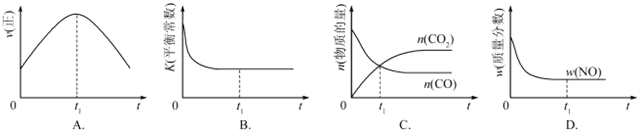
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表:
①该反应是吸热反应(填“吸热”或“放热”).
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O═CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
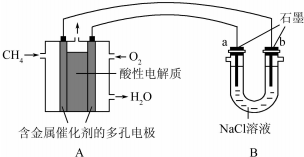
①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.
(1)汽车尾气净化的主要原理为:
2NO(g)+2CO$?_{加热}^{催化剂}$2CO2(g)+N2(g)△H<O
①该反应的速率时间罔像如图中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图中右图所示.以下说法正确的是BC(填对应字母).

A.a1>a2,B.b1<b2 C.t1>t2 D.右图中阴影部分面积更大 E.左图中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O═CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).

①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.
5.下表列出了除去物质中所含少量杂质的方法,其中不正确的是( )
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | N2 | O2 | 将气体缓缓通过足量的灼热铜网 |
| B | NaCl | KNO3 | 冷却热饱和溶液,过滤 |
| C | Cu | Zn | 加入足量稀盐酸,充分反应后过滤,洗涤,干燥 |
| D | FeCl2溶液 | CuCl2 | 加入足量铁粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
2.下列变化中,需加人适当的氧化剂才能完成的是( )
| A. | Fe→FeCl2 | B. | CuO→Cu | C. | Cl2→HCl | D. | SO3→H2SO4 |
9.下图所示的四个原电池装置,其中结论正确的是( )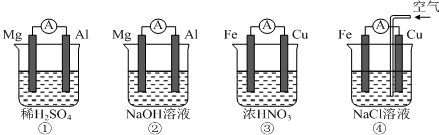

| A. | ①中Mg作负极,电子流向:Mg→稀硫酸→Al | |
| B. | ②中Al作负极,OH?迁移方向:Al→外电路→Mg | |
| C. | ③中Fe作正极,电极反应式:2H++2e?═H2↑ | |
| D. | ④中Cu作正极,电极反应式:O2+4e?+2H2O═4OH? |
19.某氯化钾样品含少量的碳酸钾、硫酸钾和不溶于水的杂质,为了提纯氯化钾,先将样品溶于适量的水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作.下列说法正确的是( )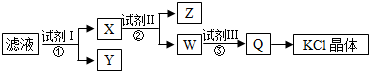

| A. | 图示的步骤中必需要经过2次过滤操作 | |
| B. | 起始滤液呈中性 | |
| C. | 试剂Ⅱ为Na2CO3溶液 | |
| D. | 试剂Ⅲ为盐酸 |
3.硅及其化合物是带来人类文明的重要物质.下列说法正确的是( )
| A. | 陶瓷、水晶、水泥、玻璃都属于硅酸盐 | |
| B. | 水玻璃是纯净物,可用于生产黏合剂和防火剂 | |
| C. | 某硅酸盐的化学式为KAlSi3O8,可用K2O.Al2 O3.6SiO2表示 | |
| D. | 高纯硅可用于制造光导纤维,高纯二氧化硅可用于制造太阳能电池 |
4.汽车排放的尾气是产生雾霾的一个因素,尾气中的下列成分与雾霾不相关的是( )
| A. | 硫氧化物 | B. | 碳氧化物 | C. | 氮氧化物 | D. | 固体颗粒物 |