题目内容
16.下列变化中属于原电池反应的是( )| A. | 铁表面镀铜,表面有划损时,也能阻止铁被氧化 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 铁丝与浓硫酸在常温下钝化 | |
| D. | 在铁与稀H2SO4反应时,加几滴CuSO4溶液,可加快H2的产生 |
分析 属于原电池反应,说明符合原电池的构成条件,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,以此解答.
解答 解:A.铁表面镀铜,表面有划损时,形成原电池装置,金属铁是负极,铜是正极,加快了金属铁的腐蚀,铁表面镀铜,表面有划损时,也能阻止铁被氧化不属于原电池原理,故A错误;
B.铝是亲氧元素,在空气中,铝极易和氧气反应生成氧化物薄膜,该反应中没有两个活泼性不同的电极,不能构成原电池,所以发生的不是原电池反应,故B错误;
C.铁丝与浓硫酸在常温下钝化,是因为二者之间的反应生成了致密的氧化物薄膜的保护作用,即“钝化”,不属于原电池反应,故C错误;
D.铁置换出铜,Fe、Cu、稀硫酸构成原电池,进而加快反应速率,属于原电池反应,故D正确.
故选D.
点评 本题考查了化学腐蚀和电化学腐蚀的判断,为高频考点,侧重于学生的分析能力的考查,根据原电池构成条件来分析解答即可,难度不大.

练习册系列答案
相关题目
6.下列对应操作正确且能达到实验目的是( )
| A. |  用图装置验证化学能转化为电能 | B. |  用图装置量取15.00mL KMnO4溶液 | ||
| C. | 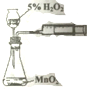 用图装置测定该化学反应速率 | D. | 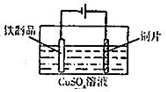 用图装置在铁制品表面镀铜 |
7.关于物质的量浓度溶液的配置说法正确的是( )
| A. | 容量瓶在使用之前要检漏 | |
| B. | 容量瓶上有温度,浓度,标线三个标识 | |
| C. | 定容时,因不慎使液面高于容量瓶的刻度线,可用滴管将多余液体吸出 | |
| D. | 配置好的溶液储存在容量瓶中,并贴上标签 |
4.雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:
2NO(g)+2CO$?_{加热}^{催化剂}$2CO2(g)+N2(g)△H<O
①该反应的速率时间罔像如图中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图中右图所示.以下说法正确的是BC(填对应字母).
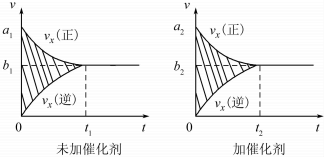
A.a1>a2,B.b1<b2 C.t1>t2 D.右图中阴影部分面积更大 E.左图中阴影部分面积更大
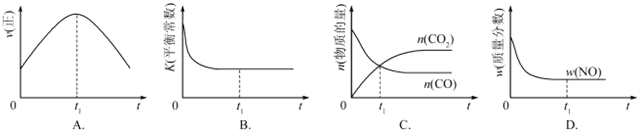
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表:
①该反应是吸热反应(填“吸热”或“放热”).
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O═CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
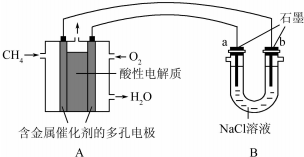
①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.
(1)汽车尾气净化的主要原理为:
2NO(g)+2CO$?_{加热}^{催化剂}$2CO2(g)+N2(g)△H<O
①该反应的速率时间罔像如图中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图中右图所示.以下说法正确的是BC(填对应字母).

A.a1>a2,B.b1<b2 C.t1>t2 D.右图中阴影部分面积更大 E.左图中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O═CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).

①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.
1.关于下列四个图象的说法中正确的是( )


| A. | 图①表示将SO2气体通入溴水中溶液PH值随SO2气体变化关系 | |
| B. | 图②表示反应N2(g)+3H2($?_{催化剂}^{高温、高压}$g)2NH3(g)△H<0的平衡常数K随温度的变化 | |
| C. | 图③中阴、阳两极收集到的气体体积之比一定为1:1 | |
| D. | 图④中的△H1<△H2 |
5.下表列出了除去物质中所含少量杂质的方法,其中不正确的是( )
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | N2 | O2 | 将气体缓缓通过足量的灼热铜网 |
| B | NaCl | KNO3 | 冷却热饱和溶液,过滤 |
| C | Cu | Zn | 加入足量稀盐酸,充分反应后过滤,洗涤,干燥 |
| D | FeCl2溶液 | CuCl2 | 加入足量铁粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
 (1)某课外活动小组同学用图1装置进行实验,试回答下列问题:
(1)某课外活动小组同学用图1装置进行实验,试回答下列问题: A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子. .
.