题目内容
9.下列各反应属于取代反应的是( )| A. | CH4+2O2→CO2+2H2O | B. | CH2=CH2+Br2→CH2Br-CH2Br | ||
| C. | CH4+Cl2→CH3Cl+HCl | D. | 2CH3CH2OH+O2→2CH3CHO+2H2O |
分析 有机化合物分子里的某些原子或原子团被其它原子或原子团所代替的反应为取代反应,根据反应物和产物特点确定反应类型.
解答 解:A.该反应为甲烷的氧化反应,故A错误;
B.该反应中乙烯和溴发生加成反应生成1,2-二溴乙烷,属于加成反应,故B错误;
C.甲烷和氯气发生取代反应生成一氯甲烷和HCl,属于取代反应,故C正确;
D.乙醇发生催化氧化反应生成乙醛和水,属于氧化反应,故D错误;
故选C.
点评 本题以有机物结构和性质为载体考查有机物结构和性质,明确官能团及其性质关系是解本题关键,注意取代反应和加成反应特点及其区别,注意:酯的水解反应和卤代烃的水解反应、酯化反应都属于取代反应.

练习册系列答案
相关题目
8.室温条件下,下列有关电解质溶液的描述正确的是( )
| A. | 向Na2CO3溶液中通入CO2至溶液为中性,则$\frac{c(N{a}^{+})}{2c(C{O}_{3}^{2-})}$>1 | |
| B. | pH相同的氨水和Ba (OH)2溶液中:2c (NH4+)=c ( Ba2+) | |
| C. | 等浓度的KHSO3溶液与KOH溶液等体积混合:c(OH-)-c(H+)=c(HSO3-)+c(H2SO3) | |
| D. | 向Mg (OH)2浊液中加入少量NH4Cl粉末$\frac{c(M{g}^{2+})}{c(O{H}^{-})}$不变 |
9.某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应.资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.该兴趣小组设计了如下实验方案验证产物并探究反应原理.
实验1:用砂纸擦去镁条表面氧化膜,将其放人盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红.
(1)提出假设
该同学对反应中产生的白色不溶物作出如下假设:
假设1:可能为Mg(OH)2.
假设2:可能为MgCO3.
假设3:可能是碱式碳酸镁[xMgCO3•yMg(OH)2]
(2)设计定性实验确定产物并验证猜测:
(3)设计定量实验确定实验I的产物:称取实验Ⅰ中所得干燥、纯净的白色不溶物6.20g,充分加热灼烧至不再产生气体为止,并使分解产生的气体全部进入装置A(盛足量浓硫酸)和B(盛足量碱石灰)中.实验前后装置A增重0.36g,装置B增重2.64g,则白色不溶物的化学式3MgCO3•Mg(OH)2或Mg4(OH)2(CO3)3.
实验1:用砂纸擦去镁条表面氧化膜,将其放人盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红.
(1)提出假设
该同学对反应中产生的白色不溶物作出如下假设:
假设1:可能为Mg(OH)2.
假设2:可能为MgCO3.
假设3:可能是碱式碳酸镁[xMgCO3•yMg(OH)2]
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 预期现象和结论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰①该气体为氢气 |
| 实验Ⅲ | 取实验I中的白色不溶物,洗涤,加入足量此空删去②稀盐酸 | 产生气泡,沉淀全部溶解;白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验I中的澄清液,向其中加入少量CaCl2溶液 | 产生白色沉淀;溶液中存在此空删去③CO32-离子 |
4.在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)═zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
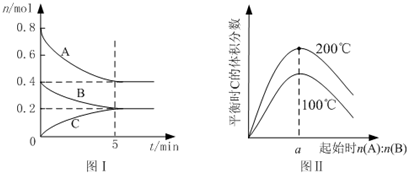

| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol•L-1•min-1 | |
| B. | 图Ⅱ所知反应xA(g)+yB(g)?zC(g)+Q(Q>0) | |
| C. | 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) | |
| D. | 由图I可知,该反应式为2A(g)+B(g)?C(g) |
14.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 反应N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol 放出热量9.2KJ时,转移电子0.6 NA | |
| B. | 7.2g CaO2晶体中阴离子和阳离子总数为0.3NA | |
| C. | 标准状况下,11.2L苯中含有碳氢键的数目为3NA | |
| D. | 0.1mol H2O2分子中含极性共价键数目为0.3NA |
1.能证明乙醇C2H6O分子有一个羟基的事实是( )
| A. | 乙醇完全燃烧生成CO2和H2O | |
| B. | 0.1 mol乙醇与足量钠反应生成0.05 mol氢气 | |
| C. | 乙醇能溶于水 | |
| D. | 乙醇能脱水 |
18.下列有关分类结果中正确的是( )
| A. | H2O、D2O、HD均是化合物 | B. | 碱性氧化物均是金属氧化物 | ||
| C. | 能与NaOH溶液反应的盐均是酸式盐 | D. | CCl4、酒精、氯气均是非电解质 |
19.SO2通入足量Fe(NO3)3稀溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀.针对上述一系列变化过程中,下列说法中不正确的是( )
| A. | 上述过程中,最终被还原的是NO3- | |
| B. | 从上述过程中可以得出结论,氧化性:HNO3>Fe3+>稀H2SO4 | |
| C. | 假设通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积为1:1 | |
| D. | 上述过程中,会产生一种无色的难溶于水的气体 |
 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.