题目内容
17. 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.(1)氧化-还原法消除氮氧化物的转化如下:NO$→_{反应Ⅰ}^{O_{3}}$NO2$→_{反应Ⅱ}^{CO(NH_{2})_{2}}$N2
①反应为:NO+O3═NO2+O2,生成11.2L O2(标准状况)时,转移电子的物质的量是1mol.
②反应Ⅱ中,当n(NO2):n[CO(NH2)2]=3:2时,反应的化学方程式是6NO2+4CO(NH2)2=7N2+8H2O+4CO2.
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1
已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,写出NO和O2反应生成NO2的热化学方程式2NO(g)+O2(g)=2NO2(g)△H=-113.0kJ•mol-1.
(3)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.
①以尿素为原料一定条件下发生反应:CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)△H=+133.6kJ/mol.该反应的化学平衡常数的表达式K=c2(NH3)•c(CO2).关于该反应的下列说法正确的是a(填序号).
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
②密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?CO (NH2)2 (s)+H2O(g),混合气体中NH3的物质的量百分含量[ϕ(NH3)]随时间变化关系如图所示.则a点的正反应速率V(正)(CO2)>b点的逆反应速率V(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是75%.
分析 (1)①化合价升高值=化合价降低值=转移电子数,根据化合价的变化来确定电子转移数目;
②反应方程式中,系数之比等于物质的量之比;
(2)根据盖斯定律结合热化学方程式的书写来回答;
(3)①化学平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值,固态和纯液体不列入;
a.该反应中只有生成物是气体,生成的氨气和二氧化碳质量和物质的量比值不变;
b.化学平衡常数只受温度影响;
c.降温平衡向逆向移动;
②图象分析氨气的体积分数从50%变化为20%后体积分数保持不变,说明b点反应达到平衡状态,a点氨气体积百分含量大于b的氨气体积百分含量,说明反应正向进行达到平衡状态,a点的正反应速率大于b点的正反应速率;依据氨气的体积分数结合平衡三段式列式计算平衡转化率.
解答 解:(1)①NO+O3═NO2+O2,生成1mol氧气转移电子是2mol,生成11.2L即0.5mol O2(标准状况)时,转移电子的物质的量是1mol,故答案为:1;
②当n(NO2):n[CO(NH2)2]=3:2,即NO2和CO(NH2)2的系数之比是3:2,其方程式表示为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2,
故答案为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2;
(2)已知:A、NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1;
B、2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,则反应:2NO(g)+O2(g)=2NO2(g)可以看成是B-2A得到的,所以该反应的△H=-196.6kJ•mol-1-2(-41.8kJ•mol-1)=-113.0 kJ•mol-1,故答案为:2NO(g)+O2(g)=2NO2(g)△H=-113.0 kJ•mol-1;
(3)①尿素和水不是气体,不列入,K=c2(NH3)•c(CO2),
a.该反应中只有生成物是气体,生成的氨气和二氧化碳质量和物质的量比值不变,故a正确;
b.化学平衡常数只受温度影响,温度不变其不变,故b错误;
c.该反应是吸热反应,降温平衡逆向移动,反应物转化率降低,故c错误;
故答案为:c2(NH3)•c(CO2);a;
②氨气的体积分数从50%变化为20%后体积分数保持不变,说明b点反应达到平衡状态,a点氨气体积百分含量大于b的氨气体积百分含量,说明反应正向进行达到平衡状态,a点的正反应速率大于b点的正反应速率,故v正(CO2)>v逆(CO2);
设氨气消耗物质的量x,开始氨气体积分数为50%,假设氨气为50mol,二氧化碳为50mol,
CO2+2NH3?(NH2)2CO+H2O
起始量(mol) 50 50 0 0
变化量(mol) 0.5x x 0.5x 0.5x
平衡量(mol) 50-0.5x 50-x 0.5x 0.5x
氨气的体积分数=$\frac{50-x}{50-0.5x+50-x+0.5x}$=20%;解得x=37.5mol,
氨气的平衡转化率=$\frac{37.5mol}{50mol}$×100%=75%,
故答案为:>;75%.
点评 本题为综合题,为高考常见题型,考查了盖斯定律求热化学方程式,化学平衡的移动及平衡的计算,平衡常数的计算,题目难度大,熟悉平衡原理是解题关键.


已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液.
(1)写出在空气中煅烧沉淀的化学反应方程式:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
(2)本流程中产生的CO2和H2,在催化剂作用下按体积比1:1合成一种重要的有机化工原料R,该合成符合绿色化学要求.已知液体R的燃烧热为254.6 kJ/mol,则R完全燃烧的热化学方程式为HCOOH(l)+$\frac{1}{2}$O2(g)═CO2(g)+H2O(g);△H=-254.6kJ/m.
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4•FeSO4•6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如表:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
(1)CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:
2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)
在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图1所示.
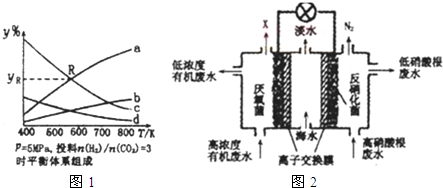
完成下列填空:
①图中曲线a表示的是H2O的体积分数.
②图中曲线a和c的交点R对应物质的体积分数yR=37.5%.
(2)25° C,H2SO3和H2CO3两种酸的电离平衡常数如表.
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.4×10-7 | 4.7×10-11 |
(3)工业上用可溶性碳酸盐提取锶时,先将SrSO4转化为难溶弱酸盐,再处理.
SrSO4?Sr2+(aq)+SO${\;}_{4}^{2-}$(aq) Ksp=2.5×10-7
SrCO3?Sr2+(aq)+CO${\;}_{3}^{2-}$(aq) Ksp=2.5×10-9
则SrSO4转化为SrCO3反应的平衡常数值为100
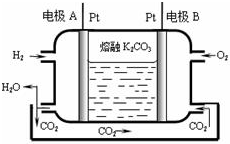
(4)图2是一种三室微生物燃料电池污水净化系统原理示意图,同时处理有机废水和硝酸盐废水,并获得淡水,图中有机废水中有机物可用C6H10O5表示.
①产生N2的电极为电池的正极(填“正”或“负”).
②生成X(气体)的电极上发生的电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+.
 碳及其化合物应用广泛.
碳及其化合物应用广泛.I.工业上利用CO和水蒸汽反应制氢气,存在以下平衡:
CO(g)+H2O(g)$\stackrel{沸石分子筛}{?}$CO2(g)+H2(g)
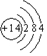
(1)沸石分子筛中含有硅元素,请写出硅原子结构示意图
 (2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.
(2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO)/mol | 0.200 | 0.160 | 0.125 | 0.099 | 0.080 | 0.080 |
| n(H2O)/mol | 0.300 | 0.260 | 0.225 | 0.199 | 0.180 | 0.180 |
(3)相同条件下,向1L恒容密闭容器中,同时注人1m o l CO、1mol H2O (g),2molCO2和2mo1H2,此时v(正 )< v(逆)(填“>”“=”或“<”)
II.已知CO(g)+$\frac{1}{2}$O2 (g)= CO2 (g)△H=-141kJ•mol-1
2H2 (g)+O2(g)= 2H2o (g)△H=-484kJ•mol-1
CH3OH(1)+$\frac{3}{2}$O2(g)=CO2 (g)+2H2O (g)△H=-726kJ•mol-1'
(4)利用CO、H2化合制得液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=+101kJ/mol
III.一种新型氢氧燃料电池工作原理如图所示
(5)写出电极A的电极反应式H2-2e-+CO32-=CO2+H2O
(6)以上述电池电解饱和食盐水,若生成0.2mo1 Cl2,则至少需通入O2的体积为2.24L(标准状况)
| A. | CH4+2O2→CO2+2H2O | B. | CH2=CH2+Br2→CH2Br-CH2Br | ||
| C. | CH4+Cl2→CH3Cl+HCl | D. | 2CH3CH2OH+O2→2CH3CHO+2H2O |
| A. | 将煤干馏制得煤焦油和焦炭 | |
| B. | 从海水中可以得到氯化镁,再加热分解可制金属镁 | |
| C. | 将石油裂解制得乙烯等化工原料 | |
| D. | 煤的气化主要反应是C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g) |
 ,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法取试样X于试管中,加入足量新制氢氧化铜悬浊液加热,出现砖红色沉淀后取上清液滴加适量稀硫酸,再加入溴水,若溴水褪色,说明X中含有碳碳双键,写出X与银氨溶液发生的离子反应方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.
,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法取试样X于试管中,加入足量新制氢氧化铜悬浊液加热,出现砖红色沉淀后取上清液滴加适量稀硫酸,再加入溴水,若溴水褪色,说明X中含有碳碳双键,写出X与银氨溶液发生的离子反应方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.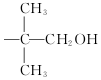 基团;
基团;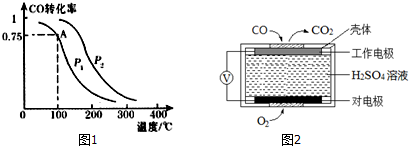
 +2H2O.
+2H2O.