题目内容
9.某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应.资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.该兴趣小组设计了如下实验方案验证产物并探究反应原理.实验1:用砂纸擦去镁条表面氧化膜,将其放人盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红.
(1)提出假设
该同学对反应中产生的白色不溶物作出如下假设:
假设1:可能为Mg(OH)2.
假设2:可能为MgCO3.
假设3:可能是碱式碳酸镁[xMgCO3•yMg(OH)2]
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 预期现象和结论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰①该气体为氢气 |
| 实验Ⅲ | 取实验I中的白色不溶物,洗涤,加入足量此空删去②稀盐酸 | 产生气泡,沉淀全部溶解;白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验I中的澄清液,向其中加入少量CaCl2溶液 | 产生白色沉淀;溶液中存在此空删去③CO32-离子 |
分析 (1)依据猜测可知白色不溶物可能是Mg(OH)2 或MgCO3或Mg(OH)2 ,MgCO3;
(2)依据实验Ⅱ的现象分析,镁条和碳酸氢钠溶液迅速反应,产生大量气泡和白色不溶物,可以说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物;气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变分析出是氢气;
依据实验Ⅲ的推断分析,加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是酸,有气泡产生,说明含有碳酸镁;加入盐酸沉淀碳酸镁全部溶解;
依据实验Ⅳ加入氯化钙生成沉淀证明含有碳酸根离子;
(3)根据B中碱石灰质量的增加量就是生成的二氧化碳的质量,根据二氧化碳的质量计算出碳酸镁的质量,剩余的就是氢氧化镁的质量.
解答 解:(1)依据猜测可知白色不溶物可能是Mg(OH)2 或MgCO3或Mg(OH)2 ,MgCO3,故答案为:Mg(OH)2 ;
(2)迅速反应,产生大量气泡和白色不溶物,可以说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物;气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变,该气体可能是氢气或一氧化碳,如果测定是一氧化碳时,燃烧后需要用到澄清石灰水,所以该气体是氢气,;
依据实验Ⅲ的推断分析,加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是酸,有气泡产生,说明含有碳酸镁;加入盐酸沉淀碳酸镁全部溶解;
依据实验Ⅳ加入氯化钙生成沉淀证明含有碳酸根离子,
故答案为:能安静燃烧、产生淡蓝色火焰,该气体为氢气;稀盐酸;CO32-;
(3)B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以生成二氧化碳的质量为2.64g,设生成2.64g二氧化碳,需要碳酸镁的质量为X则:
MgCO3+2HCl═MgCl2+H2O+CO2↑
84 44
X 2.64g
解得X=5.04g,所以含有氢氧化镁质量为:6.20g-5.04g=1.16g;
碳酸镁和氢氧化镁物质的量之比为:$\frac{5.04g}{84g/mol}$:$\frac{1.16g}{58g/mol}$=0.06:0.02=3:1,白色不溶物的化学式为3MgCO3•Mg(OH)2或Mg4(OH)2(CO3)3
故答案为:3MgCO3•Mg(OH)2或Mg4(OH)2(CO3)3.
点评 本题难度中等,考查全面,从定性和定量两个方面测定物质的种类,关键在于知道碳酸根离子与酸反应能产生二氧化碳,镁和氢离子反应生成氢气,掌握基础是解题关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | Fe→FeCl3 | B. | SiO2→Na2SiO3 | C. | Al2O3→Al(OH)3 | D. | NaO→Na2SO4 |
| A. | 原素Z、W的简单离子的电子层结构不同 | |
| B. | Y的最高价氧化物的水化物能与其简单气态氢化物反应生成盐且显碱性 | |
| C. | 由X元素形成的单质不一定是原子晶体 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将KI和H2O2溶液在试管中混合后,加入苯萃取,振荡,静置 | 上层溶液呈紫红色 | 氧化性:H2O2>I2 |
| B | 将刚刚用砂纸打磨过的铝箔放在酒精灯上加热 | 铝箔熔化,但不滴落 | 铝易被氧化;铝的熔点比氧化铝低 |
| C | 常温下,用pH试纸测量某浓度的NaHSO3溶液的pH | pH约为5.5 | 该溶液中的HSO3-的电离程度大于它的水解程度 |
| D | 向盛Mg(OH)2悬浊液的试管中加入适量NH4Cl浓溶液 | 溶液变澄清 | Mg(OH)2与NH4Cl溶液发生氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
(1)CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:
2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)
在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图1所示.
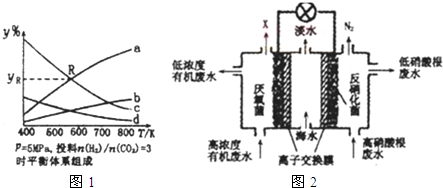
完成下列填空:
①图中曲线a表示的是H2O的体积分数.
②图中曲线a和c的交点R对应物质的体积分数yR=37.5%.
(2)25° C,H2SO3和H2CO3两种酸的电离平衡常数如表.
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.4×10-7 | 4.7×10-11 |
(3)工业上用可溶性碳酸盐提取锶时,先将SrSO4转化为难溶弱酸盐,再处理.
SrSO4?Sr2+(aq)+SO${\;}_{4}^{2-}$(aq) Ksp=2.5×10-7
SrCO3?Sr2+(aq)+CO${\;}_{3}^{2-}$(aq) Ksp=2.5×10-9
则SrSO4转化为SrCO3反应的平衡常数值为100
(4)图2是一种三室微生物燃料电池污水净化系统原理示意图,同时处理有机废水和硝酸盐废水,并获得淡水,图中有机废水中有机物可用C6H10O5表示.
①产生N2的电极为电池的正极(填“正”或“负”).
②生成X(气体)的电极上发生的电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+.
| A. | CH4+2O2→CO2+2H2O | B. | CH2=CH2+Br2→CH2Br-CH2Br | ||
| C. | CH4+Cl2→CH3Cl+HCl | D. | 2CH3CH2OH+O2→2CH3CHO+2H2O |
| A. | 失电子越多,还原性就越强,得电子越多,氧化性越强 | |
| B. | 金属单质在化学反应中一定作为还原剂,非金属单质在反应中可以作氧化剂 | |
| C. | 强电解质溶液的导电能力一定强,弱电解质溶液的导电能力一定弱 | |
| D. | 凡是强酸和强碱反应的离子方程式都可以用H++OH-=H2O表示 |
 ,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法取试样X于试管中,加入足量新制氢氧化铜悬浊液加热,出现砖红色沉淀后取上清液滴加适量稀硫酸,再加入溴水,若溴水褪色,说明X中含有碳碳双键,写出X与银氨溶液发生的离子反应方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.
,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法取试样X于试管中,加入足量新制氢氧化铜悬浊液加热,出现砖红色沉淀后取上清液滴加适量稀硫酸,再加入溴水,若溴水褪色,说明X中含有碳碳双键,写出X与银氨溶液发生的离子反应方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.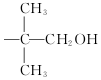 基团;
基团;