题目内容
3. X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )| A. | Z与M的最高价氧化物对应水化物均为强酸 | |
| B. | X、Y、Z三种元素组成的化合物可能是酸、碱或盐 | |
| C. | 简单离子半径:M>Y>Q | |
| D. | 电解RM2水溶液可得到R单质 |
分析 由原子半径和化合价可知X为H元素、Y为O元素、Z为N元素,M为Cl元素,Q为Na元素,R为Ca元素,结合对应单质、化合物的性质以及元素周期率知识解答该题.
解答 解:X为H元素、Y为O元素、Z为N元素,M为Cl元素,Q为Na元素,R为Ca元素,
A.Z与M的最高价氧化物对应水化物分别为硝酸、高氯酸,均为强酸,故A正确;
B.X、Y、Z三种元素组成的化合物可为HNO3、NH3•H2O或NH4NO3,分别为酸、碱、盐,故B正确;
C.氯离子比钠离子、氧离子多一个电子层,离子半径最大,氧离子比钠离子半径大,故C正确;
D.因钙为活泼金属,电解氯化钙溶液,不能得到钙的单质,故D错误.
故选D.
点评 本题考查结构性质与位置关系等,为高频考点,侧重考查学生的分析能力,难度不大,根据化合价与原子半径推断元素是解题的关键,注意对元素周期律的理解掌握.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
9.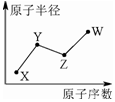 X、Y、Z、W是四种常见的短周期主族元素,其单质都是双原子气体分子.它们原子半径随原子序数的变化如下图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其单质都是双原子气体分子.它们原子半径随原子序数的变化如下图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
 X、Y、Z、W是四种常见的短周期主族元素,其单质都是双原子气体分子.它们原子半径随原子序数的变化如下图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其单质都是双原子气体分子.它们原子半径随原子序数的变化如下图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | Y、Z、W处于同一周期 | |
| B. | Y、W的最简单氢化物的水溶液能相互反应生成离子化合物 | |
| C. | 非金属性:Y>Z | |
| D. | X、Z、W形成的化合物均为强酸 |
14.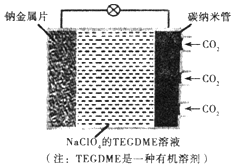 我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )
我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )
 我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )
我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )| A. | 充电时,Na+从阳极向阴极移动 | |
| B. | 可以用乙醇代替TEGDME做有机溶剂 | |
| C. | 放电时,当转移lmol电子负极质量减轻23g | |
| D. | 放电时,正极反应为3CO2+4Na++4e-=2Na2CO3+C |
11.碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如图1:
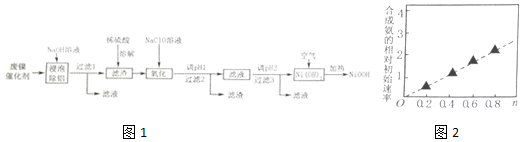
回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(2)“溶解”时放出的气体为H2、H2S(填化学式).硫酸镍溶液可用于制备合成氨的催化剂ConNi(1-n)Fe2O4.如图2表示在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是Co2+.
(3)“氧化”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
(4)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
“调pH1”时,溶液pH范围为5.6~6.2;过滤2所得滤渣的成分Cr(OH)3和Fe(OH)3(填化学式).
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式4Ni(OH)2+O2$\frac{\underline{\;加热\;}}{\;}$4NiOOH+2H2O.
(6)含镍金属氢化物MH-Ni燃料电池是一种绿色环保电池,广泛应用于电动汽车.其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M$?_{充电}^{放电}$MHx+xNiOOH;电池充电过程中阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O;放电时负极的电极反应式为MHx+xOH--xe-=M++xH2O.

回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(2)“溶解”时放出的气体为H2、H2S(填化学式).硫酸镍溶液可用于制备合成氨的催化剂ConNi(1-n)Fe2O4.如图2表示在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是Co2+.
(3)“氧化”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
(4)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr3+ | 4.5 | 5.6 |
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式4Ni(OH)2+O2$\frac{\underline{\;加热\;}}{\;}$4NiOOH+2H2O.
(6)含镍金属氢化物MH-Ni燃料电池是一种绿色环保电池,广泛应用于电动汽车.其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M$?_{充电}^{放电}$MHx+xNiOOH;电池充电过程中阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O;放电时负极的电极反应式为MHx+xOH--xe-=M++xH2O.
18.下列有机反应方程式中,不正确的是( )
| A. | 丙烯与Br2加成:CH2═CHCH3+Br2→CH2BrCH2CH2Br | |
| B. | 甲烷与Cl2发生取代反应:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| C. | 催化裂化:C16H34$→_{△}^{催化剂}$C8H16+C8H18 | |
| D. | 淀粉水解:(C6H10O5)n+nH2O$\stackrel{催化剂}{→}$nC6H12O6 |
15.常温下,取铝土矿(含有Al2O3、FeO、Fe2O3、SiO2等物质)用硫酸浸出后的溶液,分别向其中加入指定物质,反应后的溶液中能大量共存的一组离子正确的是( )
| A. | 加入过量NaOH溶液:Na+、AlO2-、OH-、SO42- | |
| B. | 加入过量氨水:NH4+、Al3+、OH-、SO42- | |
| C. | 通入过量Cl2:Fe2+、Na+、Cl-、SO42- | |
| D. | 通入过量SO2:Fe2+、H+、SO32-、SO42- |
12.X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2,Y 和Z最外层电子数之和与W的最外层电子数相同.25℃时0.1mol/LX和W形成化合物的水溶液pH为1.下列说法正确的是( )
| A. | Y和其它四种元素均可形成至少两种化合物(两种元素组成) | |
| B. | 原子半径由大到小排列的顺序是:R>W>Z>Y>X | |
| C. | 在Z、Y形成的两种离子化合物中阴阳离子的个数比均为2:1 | |
| D. | Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
13.SO2通入下列溶液中,肯定不会生成沉淀的是( )
| A. | 氯化钡溶液 | B. | 氢氧化钡溶液 | C. | 硫化氢溶液 | D. | 澄清石灰水 |
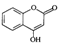 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成.
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成.
 .
. .
.