题目内容
8.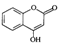 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成.
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成.
请回答下列问题:
(1)A与银氨溶液反应有银镜生成,则A的结构简式是CH3CHO.
(2)B→C的反应类型是取代反应;E的结构简式是
 .
.(3)F和过量NaOH溶液共热时反应的化学方程式为
 .
.(4)下列关于G的说法正确的是ab.
a.能与溴单质反应 b.能与金属钠反应c.1molG最多能和3mol氢气反应 d.分子式是C9H7O3.
(5)与D互为同分异构体且含酚羟基、属于酯类的有三种.
分析 A与银氨溶液反应有银镜生成,则A中存在醛基,由流程可知,A与氧气反应可以生成乙酸,则A为CH3CHO,由B和C的结构简式可以看出,乙酸分子中的羟基被氯原子取代,发生了取代反应,D与甲醇在浓硫酸条件下发生酯化反应生成E,E的结构为 ,由F的结构简式可知,C和E 在催化剂条件下脱去一个HCl分子得到F,F中存在酯基,在碱液中可以发生水解反应,结合对应物质的性质以及题目要求解答该题.
,由F的结构简式可知,C和E 在催化剂条件下脱去一个HCl分子得到F,F中存在酯基,在碱液中可以发生水解反应,结合对应物质的性质以及题目要求解答该题.
解答 解:A与银氨溶液反应有银镜生成,则A中存在醛基,由流程可知,A与氧气反应可以生成乙酸,则A为CH3CHO,由B和C的结构简式可以看出,乙酸分子中的羟基被氯原子取代,发生了取代反应,D与甲醇在浓硫酸条件下发生酯化反应生成E,E的结构为 ,
,
(1)由以上分析可知A为CH3CHO,故答案为:CH3CHO;
(2)由B和C的结构简式可以看出,乙酸分子中的羟基被氯原子取代,发生了取代反应,由以上分析可知E为 ,
,
故答案为:取代反应; :
:
(3)F中存在酯基,在碱液中可以发生水解反应,方程式为: ,
,
故答案为: ;
;
(4)G分子的结构中存在苯环、酯基、羟基、碳碳双键,所以能够与溴单质发生加成反应或者取代反应,能够与金属钠反应产生氢气,a和b正确;1molG中1mol碳碳双键和1mol苯环,所以需要4mol氢气,c错误;G的分子式为C9H6O3,d错误,
故答案为:a b;
(5)与D互为同分异构体且含酚羟基、属于酯类,则应为甲酸酯,苯环上有酚羟基,由邻、间、对三种,
故答案为:三.
点评 本题考查有机物的推断,为高考常见题型,综合考查学生分析问题的能力和化学知识的综合运用能力,题目难度中等,答题注意注意仔细审题,把握题给信息.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
19.下列关于实验室制取乙酸丁酯的叙述,正确的是( )
| A. | 使用过量的乙酸 | B. | 采用边反应边蒸馏的方法 | ||
| C. | 反应采用水浴加热 | D. | 用氢氧化钠溶液提纯乙酸丁酯 |
16.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( O-16 N-16 )( )
| A. | 1 mol甲基(CH3-)所含的电子数分别为10NA | |
| B. | 标准状况下,22.4 L四氯化碳中含有C-Cl键的数目为4NA | |
| C. | 常温常压下,1 mol分子式为C2H6O的有机物中,含有C-O键的数目为NA | |
| D. | 46g 由NO2和N2O4组成的混合气体中,含有的原子总数为3NA |
3. X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )
 X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )| A. | Z与M的最高价氧化物对应水化物均为强酸 | |
| B. | X、Y、Z三种元素组成的化合物可能是酸、碱或盐 | |
| C. | 简单离子半径:M>Y>Q | |
| D. | 电解RM2水溶液可得到R单质 |
13.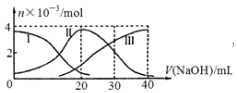 手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,如图是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,下列说法正确的是( )
手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,如图是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,下列说法正确的是( )
 手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,如图是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,下列说法正确的是( )
手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,如图是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,下列说法正确的是( )| A. | H2A在水中的电离方程式是:H2A═2H++A2- | |
| B. | 当V(NaOH)=40mL时,其溶液中水的电离受到抑制 | |
| C. | 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 当V(NaOH)=30mL时,则有:c(H+)+c(Na+)═c(A2-)+c(OH-)+c(HA-) |
20..某校化学兴趣小组探究SO2的一些性质.
[探究一]:SO2能否被BaCl2溶液吸收.
甲.乙两同学分别设计如图装置甲和装置乙进行探究
甲、乙两同学实验时观察到各仪器中的现象如下:
回答下列问题:
(1)甲同学经过后续实验确证了B中白色沉淀是BaSO4.甲同学的后续实验操作是打开B试管的胶塞,向其中滴加稀盐酸,若白色沉淀不消失,证明白色沉淀是BaSO4

(2)乙同学分析装置甲中产生BaSO4的可能原因有:
①A中产生的白雾是硫酸的酸雾,进入B中与BaCl2溶液反应生成BaSO4沉淀.
②2SO2+O2+2H2O+2Ba2+=2BaSO4+4H+(用离子方程式表示).
(3)装置乙中B中所盛试剂是饱和NaHSO3溶液;乙同学在滴加浓硫酸之前的操作是打开弹簧夹向A中通往一段时间的N2,然后关闭弹簧夹
(4)通过上述实验,得出的结论是SO2不能被BaCl2溶液吸收
[探究二]:SO2与FeCl3溶液的反应
查阅资料:①Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+;②生成Fe(HSO3)2+离子的反应为可逆反应.实验步骤为:
回答下列问题:
(5)当SO2通入到FeCl3(未用盐酸酸化)溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
则溶液由棕黄色变成红棕色的原因是二氧化硫溶于水SO2+H2O?HSO3-+H+,Fe3++HSO3-?Fe(HSO3)2+;写出溶液由红棕色变为浅绿色时发生反应的离子方程式Fe3++Fe(HSO3)2++H2O=2Fe2++SO42-+3H+
(6)通过实验可知加热和增加FeCl3溶液的酸度可缩短浅绿色出现的时间.
[探究一]:SO2能否被BaCl2溶液吸收.
甲.乙两同学分别设计如图装置甲和装置乙进行探究
甲、乙两同学实验时观察到各仪器中的现象如下:
| A | B | C | D | |
| 装置甲中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 白色沉淀 | ----- | ------ |
| 装置乙中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 有气泡 | 有气泡 | 品红褪色 |
(1)甲同学经过后续实验确证了B中白色沉淀是BaSO4.甲同学的后续实验操作是打开B试管的胶塞,向其中滴加稀盐酸,若白色沉淀不消失,证明白色沉淀是BaSO4

(2)乙同学分析装置甲中产生BaSO4的可能原因有:
①A中产生的白雾是硫酸的酸雾,进入B中与BaCl2溶液反应生成BaSO4沉淀.
②2SO2+O2+2H2O+2Ba2+=2BaSO4+4H+(用离子方程式表示).
(3)装置乙中B中所盛试剂是饱和NaHSO3溶液;乙同学在滴加浓硫酸之前的操作是打开弹簧夹向A中通往一段时间的N2,然后关闭弹簧夹
(4)通过上述实验,得出的结论是SO2不能被BaCl2溶液吸收
[探究二]:SO2与FeCl3溶液的反应
查阅资料:①Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+;②生成Fe(HSO3)2+离子的反应为可逆反应.实验步骤为:
| 步骤I | 往5mL1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤II | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
(5)当SO2通入到FeCl3(未用盐酸酸化)溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
则溶液由棕黄色变成红棕色的原因是二氧化硫溶于水SO2+H2O?HSO3-+H+,Fe3++HSO3-?Fe(HSO3)2+;写出溶液由红棕色变为浅绿色时发生反应的离子方程式Fe3++Fe(HSO3)2++H2O=2Fe2++SO42-+3H+
(6)通过实验可知加热和增加FeCl3溶液的酸度可缩短浅绿色出现的时间.
17.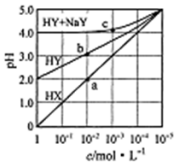 常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )
常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )
 常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )
常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )| A. | HX是强酸,溶液每稀释10倍,pH始终增大1 | |
| B. | 常温下HY的电离常数为1.0×10-4 | |
| C. | 溶液中水的电离程度:a点大于b点 | |
| D. | c 点溶液中:c(Na+)>c(Y-)>c(HY)c(H+)>c(OH-) |
18.在复杂体系中,确定化学反应先后顺序有利于解决问题.已知氧化性Fe3+>Cu2+>Fe2+.若在氯化铁溶液蚀刻铜印刷电路板后所得的溶液里加入过量锌片.下列说法正确的是( )
| A. | Fe3+首先反应,转化为Fe | B. | 反应开始时c(Fe2+)增大,然后又减小 | ||
| C. | Fe2+首先反应,转化为Fe | D. | 存在反应Fe+Cu2+→Fe2++Cu |