题目内容
下列各组离子在强碱性溶液中可以大量共存的是( )
| A、Ca2+ K+ CO32- Cl- |
| B、H+ Fe2+ Cl- NO3- |
| C、Na+ Ba2+ NO3- Cl- |
| D、Na+ Al3+ NO3- Cl- |
考点:离子共存问题
专题:离子反应专题
分析:强碱性溶液中存在大量的氢氧根离子,
A、钙离子能够与碳酸根离子、氢氧根离子反应,在溶液中不能共存;
B、氢离子、亚铁离子能够与氢氧根离子反应;硝酸根在酸性条件下能够氧化亚铁离子;
C、离子之间不反应,也不与氢氧根离子反应,溶液中能够共存;
D、铝离子能够与氢氧根离子反应,在溶液中不能共存.
A、钙离子能够与碳酸根离子、氢氧根离子反应,在溶液中不能共存;
B、氢离子、亚铁离子能够与氢氧根离子反应;硝酸根在酸性条件下能够氧化亚铁离子;
C、离子之间不反应,也不与氢氧根离子反应,溶液中能够共存;
D、铝离子能够与氢氧根离子反应,在溶液中不能共存.
解答:
解:在强碱性溶液中存在大量的氢氧根离子,
A、Ca2+与CO32-、OH-反应,在溶液中不能大量共存,故A错误;
B、酸性条件下NO3-具有强氧化性,能够氧化Fe2+,氢离子能够与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C、Na+、Ba2+、NO3-、Cl-离子之间不反应,在溶液中能够大量共存,故C正确;
D、Al3+与OH-反应,在溶液中不能大量共存,故D错误;
故选C.
A、Ca2+与CO32-、OH-反应,在溶液中不能大量共存,故A错误;
B、酸性条件下NO3-具有强氧化性,能够氧化Fe2+,氢离子能够与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C、Na+、Ba2+、NO3-、Cl-离子之间不反应,在溶液中能够大量共存,故C正确;
D、Al3+与OH-反应,在溶液中不能大量共存,故D错误;
故选C.
点评:本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况:(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
已知:Ka(HA)>Ka(HB).现有温度、物质的量浓度和体积均相同的NaA和NaB两种溶液,若前者溶液中所有离子数目为n1,后者的所有离子数目为n2,下列关系式正确的是( )
| A、n1=n2 |
| B、n1>n2 |
| C、n1<n2 |
| D、C(A-)<C(B-) |
下列物质分类都正确的一组是( )
| 碱 | 酸 | 盐 | 酸性氧化物 | |
| A | 纯碱 | 盐酸 | 烧碱 | 二氧化硫 |
| B | 烧碱 | 硫酸 | 食盐 | 一氧化碳 |
| C | 生石灰 | 醋酸 | 石灰水 | 水 |
| D | 苛性钠 | 碳酸 | 小苏打 | 三氧化硫 |
| A、A | B、B | C、C | D、D |
下列对沉淀溶解平衡的描述正确的是( )
| A、Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度 |
| B、沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 |
| C、在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大 |
| D、沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
表示下列反应的离子方程式正确的是( )
| A、铁溶于稀盐酸:2Fe+6H+=2Fe3++3H2↑ | ||||
| B、氯化铝溶液中加过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ | ||||
C、碳酸氢铵溶液中加足量氢氧化钠并加热:NH4++OH-
| ||||
| D、氯气通入水中,溶液呈酸性:Cl2+H2O?2H++Cl-+ClO- |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、常温常压下,NO2和N2O4的混合物46g中含有2NA个氧原子 |
| B、常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA |
| C、10mL98%的浓H2SO4用水稀释至l00mL,H2SO4的质量分数为9.8% |
| D、标准状况下,80g SO3中含3NA个氧原子,体积约为22.4L |
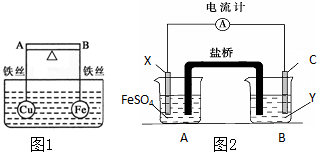 (1)如图1所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)当杠杆为绝缘体时,A端比B端
(1)如图1所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)当杠杆为绝缘体时,A端比B端