题目内容
下列叙述正确的是( )
| A、自来水用氯气消毒是因为氯气有毒,可毒死细菌、病毒 |
| B、道尔顿的原子学说存在缺陷和错误,因而意义不大 |
| C、焙制糕点时的发酵粉以小苏打为主要成分 |
| D、做焰色反应时,蘸取样品之前需用氢氧化钠溶液清洗铂丝 |
考点:氯气的化学性质,化学史,钠的重要化合物,碱金属的性质
专题:元素及其化合物,化学应用
分析:A.氯气与水反应生成的HClO,具有强氧化性;
B.道尔顿的原子学说,为化学的发展奠定基础;
C.小苏打与酸反应生成气体;
D.利用稀盐酸清洗铂丝.
B.道尔顿的原子学说,为化学的发展奠定基础;
C.小苏打与酸反应生成气体;
D.利用稀盐酸清洗铂丝.
解答:
解:A.氯气与水反应生成的HClO,具有强氧化性,可以杀死细菌、病毒,而与氯气的毒性无关,故A错误;
B.道尔顿的原子学说,虽然存在缺陷和错误,但为化学的发展奠定基础,具有一定的意义,故B错误;
C.小苏打与酸反应生成气体,则焙制糕点时的发酵粉以小苏打为主要成分,故C正确;
D.利用稀盐酸清洗铂丝,而NaOH不挥发,且干扰实验,故D错误;
故选C.
B.道尔顿的原子学说,虽然存在缺陷和错误,但为化学的发展奠定基础,具有一定的意义,故B错误;
C.小苏打与酸反应生成气体,则焙制糕点时的发酵粉以小苏打为主要成分,故C正确;
D.利用稀盐酸清洗铂丝,而NaOH不挥发,且干扰实验,故D错误;
故选C.
点评:本题考查氯气的化学性质,为高频考点,把握氯气应用于自来水消毒是生成HClO的原因为解答的关键,注重化学与生活的联系,综合性较强,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
下表是元素周期表的一部分,有关说法正确的是?( )
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA |
| 2 | c | d | |||||
| 3 | a | b | e | f |
| A、e的氢化物比d的氢化物稳定 |
| B、a、b、e三种元素的原子半径:e>b>a |
| C、六种元素中,c元素单质的化学性质最活泼 |
| D、c、e、f的最高价氧化物对应的水化物都是酸 |
下列说法不正确的是( )
| A、1g氢气在氧气中完全燃烧生成气态水,放出热量120.9kJ,氢气的燃烧热大于241.8kJ?mol-1 | |||
B、500℃30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
| |||
| C、常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |||
| D、已知中和热为-57.3 kJ?mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ |
配制一定物质的量浓度溶液时,一定不需要的仪器是( )
| A、胶头滴管 | B、量筒 |
| C、烧杯 | D、试管 |
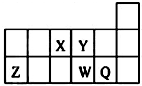 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法不正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法不正确的是( )| A、元素X与元素Z的最高正化合价之和的数值等于8 |
| B、Z的氧化物能与水反应 |
| C、离子Y2-和Z3+的核外电子数和电子层数都相同 |
| D、元素Y的氢化物的稳定性比W的氢化物强 |
设NA为阿伏加德罗常数,下列有关叙述正确的是.( )
| A、标准状况下,2.24L C6H14中含有的共用电子对数为1.9NA |
| B、同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |
| C、0.50mol的亚硫酸钠中含有的钠离子数为NA |
| D、常温下,7.1gCl2与足量NaOH溶液作用,转移电子的数目为0.2NA |
下列说法正确的是( )
| A、常温下,PH=9的碳酸钠溶液中由水电离出的c(OH-)=1×10-9mol?L-1 |
| B、温度相同时,在弱酸溶液和强碱稀溶液中,水的离子积常数Kw相同 |
| C、将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| D、中和等体积pH相同的H2SO4和HCl溶液,消耗NaOH的物质的量为2:1 |