题目内容
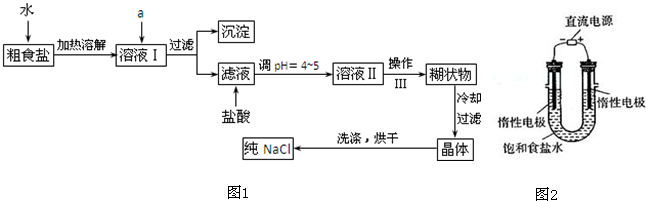
碱式碳酸铜[Cu2(OH)2C03]是一种用途广泛的化工原料.工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如图:
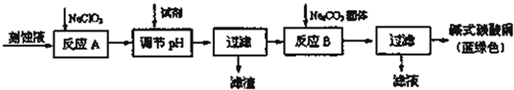
查阅资料知,通过调节溶液的酸碱性可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
(1)氯酸钠的作用是 ;
(2)调节溶液A的pH范围为 ,可以选择的试剂是 .(填序号).
a.氨水 b.硫酸铜 c.氢氧化铜 d.碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是 .
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式: .
(5)过滤得到的产品洗涤时,如何判断产品已经洗净 .

查阅资料知,通过调节溶液的酸碱性可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1,4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
(2)调节溶液A的pH范围为
a.氨水 b.硫酸铜 c.氢氧化铜 d.碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:
(5)过滤得到的产品洗涤时,如何判断产品已经洗净
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:由流程图可知:刻蚀废液加入NaClO3把亚铁离子氧化为铁离子,调节pH除掉铁离子,滤渣为Fe(OH)3,向CuCl2溶液中加入碳酸钠固体,过滤得到碱式碳酸铜.
(1)氯酸钠是氧化剂,氧化亚铁离子为铁离子易于除去;
(2)调节pH使得铁离子沉淀完全,而铜离子不能开始沉淀,为了不引入杂质,选合适的碱性物质调节pH;
(3)温度低于100℃,为了便于控制温度,可采取水浴加热的方法;
(4)根据题给信息,铜离子和碳酸根离子反应生成碱式碳酸铜和碳酸氢根离子,据此写出反应的离子方程式;
(5)设计实验检验滤液中是否含有氯离子证明是否洗涤干净.
(1)氯酸钠是氧化剂,氧化亚铁离子为铁离子易于除去;
(2)调节pH使得铁离子沉淀完全,而铜离子不能开始沉淀,为了不引入杂质,选合适的碱性物质调节pH;
(3)温度低于100℃,为了便于控制温度,可采取水浴加热的方法;
(4)根据题给信息,铜离子和碳酸根离子反应生成碱式碳酸铜和碳酸氢根离子,据此写出反应的离子方程式;
(5)设计实验检验滤液中是否含有氯离子证明是否洗涤干净.
解答:
解:由流程图可知:刻蚀废液加入NaClO3把Fe2+氧化为Fe3+,调节pH除掉铁离子,滤渣为Fe(OH)3,向CuCl2溶液中加入碳酸钠固体,过滤得到碱式碳酸铜.
(1)酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备碱式碳酸铜,需除去杂质离子,而亚铁离子形成沉淀比铜离子还难,故需把亚铁离子转化为铁离子,加入氯酸钠的作用是氧化亚铁离子为铁离子,调节溶液pH易于把铁离子沉淀除去,故答案为:将Fe2+氧化成Fe3+;
(2)调节pH使得铁离子沉淀完全,铁离子沉淀完全pH为3.7,铜离子开始沉淀pH为6.0,故应控制pH为3.7-6.0,使铁离子沉淀完全而铜离子不沉淀;
氨水会引入杂质离子,硫酸铜不能使溶液pH升高,氢氧化铜和碳酸铜能和氢离子反应,能调节pH,且不会引入杂质,可用作调节pH的试剂;
故答案为:3.7-6.0;cd;
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用水浴加热的方法,便于控制温度;
故答案为:水浴加热;
(4)根据题给信息,铜离子和碳酸根离子反应生成碱式碳酸铜和碳酸氢根离子,反应的离子方程式为:2Cu2++3CO32-+2H2O=Cu2(OH)2C03↓+2HCO3-,
故答案为:2Cu2++3CO32-+2H2O=Cu2(OH)2C03↓+2HCO3-;
(5)沉淀表面会含有氯化钠溶液,设计实验检验是否含有氯离子的方法可以检验是否洗涤干净,实验设计为:取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净,故答案为:取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净.
(1)酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备碱式碳酸铜,需除去杂质离子,而亚铁离子形成沉淀比铜离子还难,故需把亚铁离子转化为铁离子,加入氯酸钠的作用是氧化亚铁离子为铁离子,调节溶液pH易于把铁离子沉淀除去,故答案为:将Fe2+氧化成Fe3+;
(2)调节pH使得铁离子沉淀完全,铁离子沉淀完全pH为3.7,铜离子开始沉淀pH为6.0,故应控制pH为3.7-6.0,使铁离子沉淀完全而铜离子不沉淀;
氨水会引入杂质离子,硫酸铜不能使溶液pH升高,氢氧化铜和碳酸铜能和氢离子反应,能调节pH,且不会引入杂质,可用作调节pH的试剂;
故答案为:3.7-6.0;cd;
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用水浴加热的方法,便于控制温度;
故答案为:水浴加热;
(4)根据题给信息,铜离子和碳酸根离子反应生成碱式碳酸铜和碳酸氢根离子,反应的离子方程式为:2Cu2++3CO32-+2H2O=Cu2(OH)2C03↓+2HCO3-,
故答案为:2Cu2++3CO32-+2H2O=Cu2(OH)2C03↓+2HCO3-;
(5)沉淀表面会含有氯化钠溶液,设计实验检验是否含有氯离子的方法可以检验是否洗涤干净,实验设计为:取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净,故答案为:取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净.
点评:本题考查了制备实验方案的设计,中等难度,注重了基本操作的考查,书写离子反应方程式为难点,需要结合题给信息,根据电荷守恒和原子守恒写出正确的方程式.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
2013年2月,俄罗斯境内有大量陨石坠落,经化学分析,陨石中游离态的铁含量约为10%,此外还有橄榄石(Fe2SiO4)、亚硫酸盐等成分,下列有关说法正确的是( )
| A、此陨石是一种纯度较高的硅酸盐矿石 |
| B、此陨石具有耐酸碱的特性 |
| C、陨石中含有游离态的铁是因为在外太空中铁的活性比地球上铁的活性低 |
| D、橄榄石中Fe为+2价 |
天然碱的组成可以用aNa2CO3?bNaHCO3?cH2O(a、b、c为整数)表示.通过以下实验测定某天然碱的化学式,将质量为12.45g的某天然碱溶于水,逐滴滴加某浓度的稀盐酸,产生气体的体积与加入盐酸的体积(标准状况)的关系如下表所示:下列说法错误的是( )
| 盐酸体积(mL) | 20 | 40 | 60 | 80 |
| 产生气体体积(mL) | 0 | 560 | 1680 | 2520 |
| A、加入盐酸体积小于20 mL时,体系发生的离子反应为:CO32-+H+═HCO3- |
| B、加入盐酸体积为50 mL时,产生气体(标准状况)的体积为1120mL |
| C、本实验使用盐酸的浓度为2.5 mol?L-1 |
| D、该天然碱的化学式为Na2CO3?2NaHCO3?2H2O |

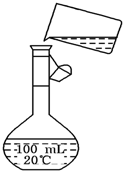 电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO
电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO
 的名称:
的名称: