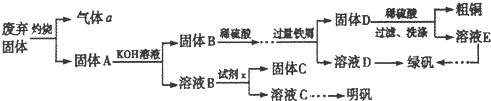
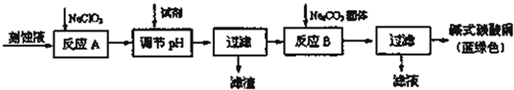
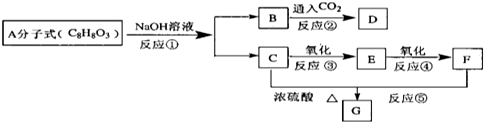
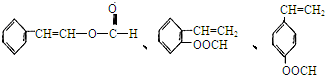题目内容
四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子;B的基态原子s能级的总电子数比p能级的总电子数多1;C元素的原子最外层电子数是次外层的3倍; D是形成化合物种类最多的元素.
(1)A、D形成的化合物D2A4分子中σ键和π键数目之比为 ;B的基态原子电子排布图为 . A、C形成的化合物A2C2分子属于 (“极性分子”或“非极性分子”),其电子式
(2)与PH3相比,BA3易液化的主要原因是 ;
(3)BC3-的立体构型为 ,BC3-中B原子轨道的杂化类型为 .
(1)A、D形成的化合物D2A4分子中σ键和π键数目之比为
(2)与PH3相比,BA3易液化的主要原因是
(3)BC3-的立体构型为
考点:位置结构性质的相互关系应用,极性分子和非极性分子,原子轨道杂化方式及杂化类型判断
专题:
分析:四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子,则A为H;B的基态原子s能级的总电子数比p能级的总电子数多1,电子排布为1s22s22p3,则B为N;C元素的原子最外层电子数是次外层的3倍,则应为2个电子层,最外层电子数为6,即C为O; D是形成化合物种类最多的元素,D为C元素,以此来解答.
解答:
解:四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子,则A为H;B的基态原子s能级的总电子数比p能级的总电子数多1,电子排布为1s22s22p3,则B为N;C元素的原子最外层电子数是次外层的3倍,则应为2个电子层,最外层电子数为6,即C为O; D是形成化合物种类最多的元素,D为C元素,
(1)A、D形成的化合物D2A4分子,含4个C-H和1个C=C键,则σ键和π键数目之比为5:1;B的基态原子电子排布图为 ;A、C形成的化合物A2C2分子的电子式为
;A、C形成的化合物A2C2分子的电子式为 ,属于极性分子,
,属于极性分子,
故答案为:5:1; ;极性;
;极性; ;
;
(2)与PH3相比,BA3易液化,是因氨气分子之间存在氢键,沸点高易液化,故答案为:氨气分子之间存在氢键;
(3)NO3-离子中N原子价层电子对数=3+
=3,N原子采取sp2杂化,则BC3-的立体构型为平面三角形,故答案为:平面三角形;sp2.
(1)A、D形成的化合物D2A4分子,含4个C-H和1个C=C键,则σ键和π键数目之比为5:1;B的基态原子电子排布图为
 ;A、C形成的化合物A2C2分子的电子式为
;A、C形成的化合物A2C2分子的电子式为 ,属于极性分子,
,属于极性分子,故答案为:5:1;
 ;极性;
;极性; ;
;(2)与PH3相比,BA3易液化,是因氨气分子之间存在氢键,沸点高易液化,故答案为:氨气分子之间存在氢键;
(3)NO3-离子中N原子价层电子对数=3+
| 5+1-2×3 |
| 2 |
点评:本题考查位置、结构、性质的关系及应用,为高频考点,把握原子结构、电子排布推断元素为解答的关键,侧重物质结构与性质的考查及分析、推断能力的考查,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A、1molCH4分子共价键总数为NA |
| B、含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1mol/L |
| C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
| D、1molMg与足量O2或N2反应生成MgO或Mg3N2失去电子分别为2NA和3NA |
某有机物的化学式为C5H10O,它能发生银镜反应.若将其跟H2加成所得产物的结构简式不可能是( )
| A、CH3(CH2)3CH2OH |
| B、CH3CH2CH(CH3)CH2OH |
| C、(CH3)2CHCH2CH2OH |
| D、(CH3CH2)2CHOH |
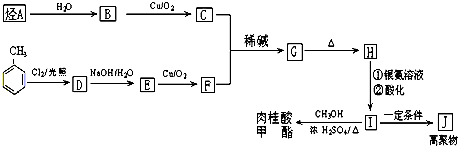
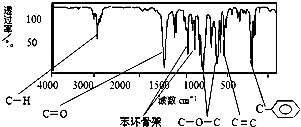 肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.
肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.