题目内容
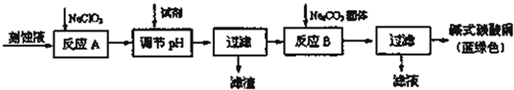
碳酸锂广泛应用与陶瓷和医药等领域,以锂辉石(主要成分为LiAlSi2O6)为原材料制备Li2CO3的工艺流程如下:

已知:①2LiAlSi2O6+H2SO4(浓)=LiSO4+Al2O3?4SiO2?H2O
②Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、4.7、9.0和11.1
③某些物质的溶解度(S)如下表
请回答下列问题:
(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒的目的是
(2)滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、Mg2+、Ca2+、Na+等杂质,步骤Ⅱ需在搅拌下加入石灰石以调节溶液的PH到6.0-6.5,此时沉淀的杂质离子有 ;石灰石调节溶液PH的原理的离子方程式为 .
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子方程式为
(4)步骤Ⅲ中加入饱和Na2CO3溶液过滤后需要用热水洗涤的原因是
(5)从滤液c中可回收的主要物质是 .

已知:①2LiAlSi2O6+H2SO4(浓)=LiSO4+Al2O3?4SiO2?H2O
②Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、4.7、9.0和11.1
③某些物质的溶解度(S)如下表
| t/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(LiSO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒的目的是
(2)滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、Mg2+、Ca2+、Na+等杂质,步骤Ⅱ需在搅拌下加入石灰石以调节溶液的PH到6.0-6.5,此时沉淀的杂质离子有
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子方程式为
(4)步骤Ⅲ中加入饱和Na2CO3溶液过滤后需要用热水洗涤的原因是
(5)从滤液c中可回收的主要物质是
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:锂辉石(主要成分为LiAlSi2O6)粉碎加硫酸,浸取、过滤,滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、Mg2+、Ca2+、Na+等杂质,加石灰石以调节溶液的PH到6.0-6.5,则Fe3+、Al3+转化为氢氧化物沉淀,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可以除去Fe2+、Mg2+、Ca2+;在温度较高时Li2CO3的溶解度较小,以沉淀的形式析出;
(1)从反应速率的角度来分析;
(2)根据Fe3+、Al3+生成沉淀时的pH分析;碳酸钙与氢离子反应生成二氧化碳、水和钙离子;
(3)H2O2把亚铁离子氧化为铁离子;
(4)温度较高时Li2CO3的溶解度较小;
(5)滤液c含有钠离子和硫酸根离子.
(1)从反应速率的角度来分析;
(2)根据Fe3+、Al3+生成沉淀时的pH分析;碳酸钙与氢离子反应生成二氧化碳、水和钙离子;
(3)H2O2把亚铁离子氧化为铁离子;
(4)温度较高时Li2CO3的溶解度较小;
(5)滤液c含有钠离子和硫酸根离子.
解答:
解:锂辉石(主要成分为LiAlSi2O6)粉碎加硫酸,浸取、过滤,滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、Mg2+、Ca2+、Na+等杂质,加石灰石以调节溶液的PH到6.0-6.5,则Fe3+、Al3+转化为氢氧化物沉淀,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可以除去Fe2+、Mg2+、Ca2+;在温度较高时Li2CO3的溶解度较小,以沉淀的形式析出;
(1)固体颗粒越小,化学反应速率越快,同时可使锂元素尽可能多地溶解到酸中,
故答案为:增大固液接触面积,加快浸出反应速率,提高浸出率;
(2)已知Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、4.7、9.0和11.1
,在搅拌下加入石灰石以调节溶液的PH到6.0-6.5,则Fe3+、Al3+转化为氢氧化物沉淀,所以除去的离子为Al3+、Fe3+;碳酸钙与氢离子反应生成二氧化碳、水和钙离子,其离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑;
故答案:Al3+、Fe3+;CaCO3+2H+=Ca2++H2O+CO2↑;
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,H2O2把亚铁离子氧化为铁离子,发生氧化还原反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(4)有表中数据可知,温度较高时Li2CO3的溶解度较小,为了减少洗涤时Li2CO3的溶解,加入饱和Na2CO3溶液过滤后需要用热水洗涤;
故答案为:Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失;
(5)根据流程可知前面所加的钠离子和硫酸根离子在分离过程中没有被除去,所以滤液c含有钠离子和硫酸根离子,则滤液c中可回收的主要物质是Na2SO4;
故答案为:Na2SO4.
(1)固体颗粒越小,化学反应速率越快,同时可使锂元素尽可能多地溶解到酸中,
故答案为:增大固液接触面积,加快浸出反应速率,提高浸出率;
(2)已知Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、4.7、9.0和11.1
,在搅拌下加入石灰石以调节溶液的PH到6.0-6.5,则Fe3+、Al3+转化为氢氧化物沉淀,所以除去的离子为Al3+、Fe3+;碳酸钙与氢离子反应生成二氧化碳、水和钙离子,其离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑;
故答案:Al3+、Fe3+;CaCO3+2H+=Ca2++H2O+CO2↑;
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,H2O2把亚铁离子氧化为铁离子,发生氧化还原反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(4)有表中数据可知,温度较高时Li2CO3的溶解度较小,为了减少洗涤时Li2CO3的溶解,加入饱和Na2CO3溶液过滤后需要用热水洗涤;
故答案为:Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失;
(5)根据流程可知前面所加的钠离子和硫酸根离子在分离过程中没有被除去,所以滤液c含有钠离子和硫酸根离子,则滤液c中可回收的主要物质是Na2SO4;
故答案为:Na2SO4.
点评:本题考查了物质分离提纯实验操作,涉及离子共存、离子方程式、氧化还原反应、物质的鉴别与分离等,考查考生运用金属元素的有关知识分析解决问题的能力,题目难度中等.

练习册系列答案
相关题目
某有机物的化学式为C5H10O,它能发生银镜反应.若将其跟H2加成所得产物的结构简式不可能是( )
| A、CH3(CH2)3CH2OH |
| B、CH3CH2CH(CH3)CH2OH |
| C、(CH3)2CHCH2CH2OH |
| D、(CH3CH2)2CHOH |
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是(其他操作均正确)( )
| A、溶解后未冷却至室温就移入容量瓶 |
| B、向容量瓶加水时液面低于刻度线即摇匀 |
| C、称量时间过长 |
| D、向容量瓶加水定容时眼睛俯视刻度线 |
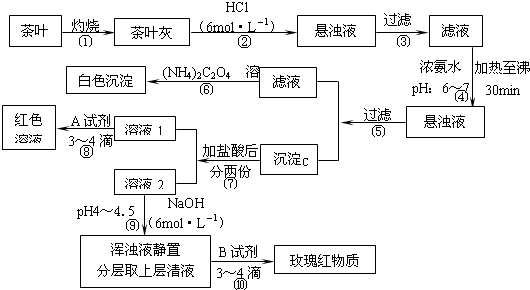
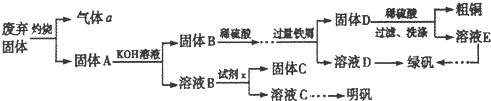
 (1)如图分别是温度计、量筒、滴定管的一部分,则:量筒应该是
(1)如图分别是温度计、量筒、滴定管的一部分,则:量筒应该是