题目内容
19.A,B,C,D,E,F,G为7种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下,其中:B的离子半径大于E的离子半径;D是由极性键构成的4原子分子;C与F可形成D和G分子.| 微粒 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
 .
.(2)用电子式表示D的形成过程:

(3)比较B与E相应元素的最高价氧化物对应水化物的碱性强弱,为NaOH>Mg(OH)2(用化学式表示).
(4)D与G反应的化学方程式是NH3+H2O═NH3•H2O.
(5)C粒子是
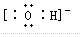 ,F粒子是
,F粒子是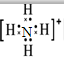 (用电子式表示).
(用电子式表示).
分析 A,B,C,D,E,F,G为7种由短周期元素构成的粒子,它们都有10个电子.A为单核,电荷为0,则A为Ne原子;B为单核,电荷为1+,则B为Na+;C为双核,电荷为1-,则C为OH-;D为多核,D是由极性键构成的4原子极性分子,电荷为0,则D为NH3;E为单核,电荷为2+,则E为 Mg2+;F为多核,电荷为1+,C(OH-)与F可形成D(NH3)和G,则F为NH4+,G为多核,电荷为0,则G为H2O,据此进行解答.
解答 解:A,B,C,D,E,F,G为7种由短周期元素构成的粒子,它们都有10个电子.A为单核,电荷为0,则A为Ne原子;B为单核,电荷为1+,则B为Na+;C为双核,电荷为1-,则C为OH-;D为多核,D是由极性键构成的4原子极性分子,电荷为0,则D为NH3;E为单核,电荷为2+,则E为 Mg2+;F为多核,电荷为1+,C(OH-)与F可形成D(NH3)和G,则F为NH4+,G为多核,电荷为0,则G为H2O,
(1)A为Ne原子,核外电子数为10,有2个电子层,最外层电子数为8,结构示意图为其结构示意图为: ,
,
故答案为: ;
;
(2)D为NH3,氨气为共价化合物,用电子式表示其形成过程为 ,
,
故答案为: ;
;
(3)B元素的最高价氧化物对应水化物为NaOH,E元素的最高价氧化物对应水化物为Mg(OH)2,金属性Na>Mg,则碱性NaOH>Mg(OH)2,
故答案为:NaOH;Mg(OH)2;
(4)D为NH3,G为H2O,NH3与H2O在溶液中反应生成NH3•H2O,反应的化学方程式为:NH3+H2O═NH3•H2O,
故答案为:NH3+H2O═NH3•H2O;
(5)由以上分析可知,C为OH-,F为NH4+,OH-的电子式为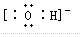 ,NH4+的电子式为
,NH4+的电子式为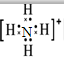 ,
,
故答案为: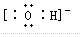 ;
;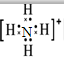 .
.
点评 本题考查中学常见10电子微粒、常用化学用语、元素周期律等知识,题目难度不大,熟练掌握常见10电子微粒为解答关键,注意掌握常见化学用语的概念及书写原则,试题培养了学生的分析能力及综合应用能力.

| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0kJ/mol(燃烧热) | |
| B. | H2SO4(aq)+2NaOH (aq)═Na2SO4(aq)+2H2O (l)△H=-114.6kJ/mol(中和热) | |
| C. | S (s)+O2(g)═SO2 (g)△H=-296.8kJ/mol(燃烧热) | |
| D. | 2NO2═O2+2NO△H=+116.2kJ/mol(反应热) |
| A. | 该溶液的pH<7 | B. | CN-的水解程度大于HCN的电离程度 | ||
| C. | c(CN-)+c(HCN)=0.02 mol•L-1 | D. | c(CN-)+c(OH-)=0.01 mol•L-1+c(H+) |
| A. | 二氧化碳、BaSO4 | B. | 盐酸、蔗糖 | C. | KNO3、乙醇 | D. | NaOH、液氯 |
| A. | 共价化合物中原子都一定满足最外层8电子结构 | |
| B. | 通过共价键形成的分子一定是共价化合物 | |
| C. | 共价化合物中可能含有离子键 | |
| D. | 微粒间通过共价键形成的晶体,具有较高的熔、沸点 |
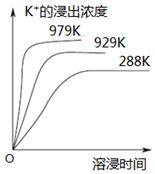 已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4 (s)?2Ca2++2K++Mg2++4SO42-.不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )
已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4 (s)?2Ca2++2K++Mg2++4SO42-.不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )| A. | 该平衡的Ksp=c2(Ca2+)•c2(K+)•c(Mg2+)•c4(SO42-) | |
| B. | 向该体系中加入饱和K2SO4溶液,溶解平衡向左移动 | |
| C. | 升高温度,溶浸速率增大,平衡向正反应方向移动 | |
| D. | 向该体系中加入饱和NaOH溶液,溶解平衡不发生移动 |
| A. | 甲苯的一氯代物有三种同分异构体 | |
| B. | 乙醇能使高锰酸钾溶液褪色 | |
| C. | 乙烯、苯、乙酸分子中的所有原子都在同一个平面上 | |
| D. | C2H4O2和C4H8O2分子组成相差2个CH2,一定互为同系物 |
| A. | HCl→Cl2→HClO→NaClO | B. | Na→Na2O2→Na2CO3→NaHCO3 | ||
| C. | Al→NaAlO2→Al(OH)3→Al2O3 | D. | Si→SiO2→H2SiO3→Na2SiO3 |