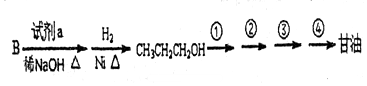题目内容
16.黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源.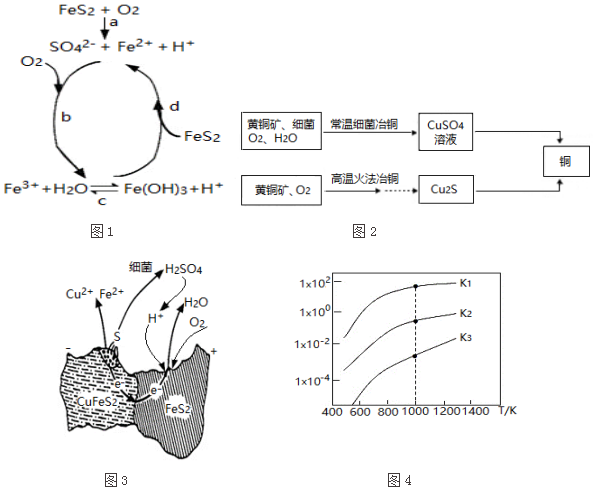
(1)黄铁矿在空气中易被氧化,其反应历程可能为如图1所示的四步:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用黄铜矿常温细菌冶铜和高温火法冶铜的流程如图2所示:
①细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高Cu2+的浸出速率,
其原理如图3所示:
Ⅰ.冶炼过程中,FeS2周边溶液的pH增大(填“增大”、“减小”或“不变”).
Ⅱ.从CuFeS2析出S的反应式是CuFeS2-4e-=Cu2++Fe2++2S.
②火法冶铜时,由Cu2S制得铜的化学方程式是Cu2S+O2 $\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数与温度的关系如图4.
| 相关反应 | 反应热 | 平衡常数 |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
②提高硫的脱除率可采取的措施有升高温度(举1例).
分析 (1)a反应原理是硫化亚铁中的硫离子被氧化生成硫酸根,化合价变化为:+6-(-1)=7;d反应原理是硫化亚铁与铁离子反应,铁离子被还原生成亚铁离子,硫离子被氧化为硫酸根离子;
(2)①Ⅰ.用细菌冶铜时,正极为氧气放电,氧气得到电子,结合溶液中的氢离子生成水;
Ⅱ.负极黄铁矿中的硫失去电子,发生氧化反应生成硫单质;
②火法冶铜时,Cu2S与氧气反应生成铜和二氧化硫;
(3)①由图可知,温度越高,K值越大,说明此反应为吸热反应;
②由图可知:温度升高,反应向正反应方向移动,硫的脱除率越高.
解答 解:(1)①a反应原理是硫化亚铁中的硫离子被氧化生成硫酸根,化合价变化为:+6-(-1)=7,即每有1molFeSO4生成转移移电子的物质的量为7mol,故答案为:7;
②d反应原理是硫化亚铁与铁离子反应,铁离子被还原生成亚铁离子,硫离子被氧化为硫酸根,离子反应方程式为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,
故答案为:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+;
(2)①Ⅰ.FeS2周边即正极为氧气放电,氧气得到电子,结合溶液中的H+离子生成水,故溶液中氢离子浓度减小,pH值增大,故答案为:增大;
Ⅱ.负极黄铁矿中的硫失去电子,发生氧化反应生成硫单质,电极反应方程式为:CuFeS2-4e-=Cu2++Fe2++2S,故答案为:CuFeS2-4e-=Cu2++Fe2++2S;
②火法冶铜时,Cu2S与氧气反应生成铜和二氧化硫,方程式为:Cu2S+O2 $\frac{\underline{\;高温\;}}{\;}$2Cu+SO2;故答案为:Cu2S+O2 $\frac{\underline{\;高温\;}}{\;}$2Cu+SO2;
(3)①由图可知,温度越高,K值越大,说明此反应为吸热反应,故△H>0,故答案为:>;
②由图可知:此反应为吸热反应,故升高温度,可以使反应向正向移动,即硫的脱除率越高,故答案为:升高温度.
点评 本题主要考查氧化还原反应、离子反应方程式书写、反应热判断等,侧重考查学生分析推理能力,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案| A. | 石油的分馏 | B. | 石油裂化 | C. | 石油裂解 | D. | 煤的干馏 |
| A. | 二氧化碳、BaSO4 | B. | 盐酸、蔗糖 | C. | KNO3、乙醇 | D. | NaOH、液氯 |
| A. | 共价化合物中原子都一定满足最外层8电子结构 | |
| B. | 通过共价键形成的分子一定是共价化合物 | |
| C. | 共价化合物中可能含有离子键 | |
| D. | 微粒间通过共价键形成的晶体,具有较高的熔、沸点 |
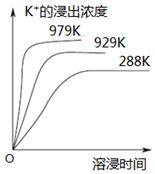 已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4 (s)?2Ca2++2K++Mg2++4SO42-.不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )
已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4 (s)?2Ca2++2K++Mg2++4SO42-.不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )| A. | 该平衡的Ksp=c2(Ca2+)•c2(K+)•c(Mg2+)•c4(SO42-) | |
| B. | 向该体系中加入饱和K2SO4溶液,溶解平衡向左移动 | |
| C. | 升高温度,溶浸速率增大,平衡向正反应方向移动 | |
| D. | 向该体系中加入饱和NaOH溶液,溶解平衡不发生移动 |
| A. | 20°C时,28g N2所含的原子数为2NA个 | |
| B. | 标况下,0.5NA个水分子所占体积约为11.2L | |
| C. | CH4的摩尔质量在数值上等于NA个甲烷分子的质量之和 | |
| D. | 1gCO与1gCO2所含碳原子数之比是1:1 |
| A. | 甲苯的一氯代物有三种同分异构体 | |
| B. | 乙醇能使高锰酸钾溶液褪色 | |
| C. | 乙烯、苯、乙酸分子中的所有原子都在同一个平面上 | |
| D. | C2H4O2和C4H8O2分子组成相差2个CH2,一定互为同系物 |
(1)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在表②③⑥的后面.
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥K2CO3 | ⑦CO2 ⑧Na2O2 |
(3)实验室制备⑦常用石灰石和盐酸反应,检验该气体的方法是Ca(OH)2+CO2═CaCO3+H2O.(化学方程式)
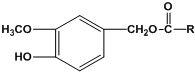 (R为烃基)
(R为烃基)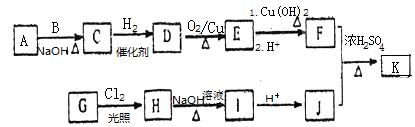
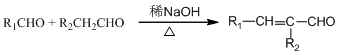
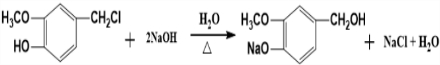 ,
, ,
,