题目内容
2.氮化铝(AlN)是一种新型无机非金属材料,其制取原理为:Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.在制取氮化铝时由于反应不完全,产品中有氧化铝和碳.
为了分析某AlN样品的组成,某实验小组进行了如下探究.
【实验1】测定样品中氮元素的质量分数.
取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去).
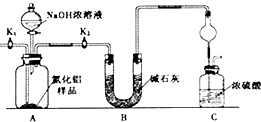
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
(1)如图C装置中球形干燥管的作用是防倒吸.
(2)完成以下实验步骤:组装好实验装置,首先检查装置气密性,再加入实验药品.然后关闭K1,打开K2;把装置中残留的氨气全部赶入C装置,
打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,缓缓通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是把装置中残留的氨气全部赶入C装置.
(3)若去掉装置B,则导致测定结果偏高(填“偏高”、“偏低”或“无影响”).由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见C装置出口处连接一个干燥装置.
【实验2】按以下步骤测定样品中铝元素的质量分数.
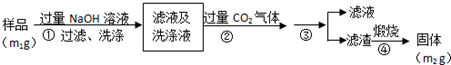
(4)步骤②生成沉淀的离子方程式为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓.
(5)操作③需要的玻璃仪器有漏斗、玻璃棒及烧杯.
(6)A1元素的质量分数为$\frac{{9{m_2}}}{{17{m_1}}}×100%$(用m1、m2表示).
【实验3】测定样品中碳元素的质量分数.
称取10.00g样品置于反应器中,通往2.24LO2,在高温下充分反应后得到3.36L气体(AlN不跟O2反应),测得其密度为1.61g•L-1(体积及密度均已换算成标准状况).
(7)计算该样品中碳元素的质量分数16%.
分析 [实验1]
测定原理是通过测定A1N+NaOH+H2O=NaAlO2+NH3↑反应生成氨气的质量来计算氮化铝的含量,则A中发生的反应为A1N+NaOH+H2O=NaAlO2+NH3↑,生成的氨气被碱石灰干燥,然后将氨气通入稀硫酸中被硫酸吸收生成硫酸铵,通入的氮气能将生成的氨气完全排出;
(1)氨气极易溶于水和稀硫酸,缓冲装置能防止倒吸;
(2)组装好实验装置,气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是,反应生成氨气后把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算;
(3)浓硫酸具有吸水性,能吸收氨气中的水蒸气;浓硫酸能吸收空气中的水蒸气;
[实验2]
测定原理是通过测定A1N+NaOH+H2O=NaAlO2+NH3↑反应生成氨气的体积来计算氮化铝的含量,样品溶液过量NaOH溶液,发生反应A1N+NaOH+H2O=NaAlO2+NH3↑,向滤液中通入过量二氧化碳,发生的反应为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,然后过滤,得到的滤渣为Al(OH)3,煅烧滤渣,发生反应2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
(4)偏铝酸钠和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠;
(5)过滤时需要的玻璃仪器有漏斗、玻璃棒及烧杯;
(6)根据Al原子守恒计算;
[实验3]
(7)气体产物的平均摩尔质量=1.61g•L-1×22.4L/mol=36g/mol,氧气不足,生成气体是CO和CO2混合气体,CO与CO2的物质的量之比为(44-36):(36-28)=1:1,氧气的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,
设CO2为y mol,由氧原子守恒:y+2y=0.1×2,
解得x=$\frac{0.2}{3}$
故碳元素质量为($\frac{0.2}{3}$mol+$\frac{0.2}{3}$mol)×12g/mol=1.6g,
C元素质量分数=$\frac{C元素质量}{样品质量}$.
解答 解:[实验1]
测定原理是通过测定A1N+NaOH+H2O=NaAlO2+NH3↑反应生成氨气的质量来计算氮化铝的含量,则A中发生的反应为A1N+NaOH+H2O=NaAlO2+NH3↑,生成的氨气被碱石灰干燥,然后将氨气通入稀硫酸中被硫酸吸收生成硫酸铵,通入的氮气能将生成的氨气完全排出;
(1)氨气极易溶于水和稀硫酸,缓冲装置能防止倒吸,导致的干燥管有缓冲作用,所以能防止倒吸,
故答案为:防倒吸;
(2)有连接的装置在使用前必须检查装置气密性,所以该实验之前必须检验装置气密性;然后加入药品,将关闭K1,打开K2同时打开分液漏斗的活塞,从而发生A中的反应;通入的氮气能把装置中残留的氨气全部赶入C装置,否则易导致测定结果偏小,
故答案为:检查装置气密性;关闭K1,打开K2;把装置中残留的氨气全部赶入C装置;
(3)浓硫酸具有吸水性,能吸收氨气中的水蒸气,如果去掉装置B,则氨气中的水蒸气被浓硫酸吸收而导致测定结果偏大;C装置直接连接空气,浓硫酸能吸收空气中的水蒸气而导致测定结果偏高,其改进措施为C装置出口处连接一个干燥装置,
故答案为:偏高;C装置出口处连接一个干燥装置;
[实验2]
测定原理是通过测定A1N+NaOH+H2O=NaAlO2+NH3↑反应生成氨气的体积来计算氮化铝的含量,样品溶液过量NaOH溶液,发生反应A1N+NaOH+H2O=NaAlO2+NH3↑,向滤液中通入过量二氧化碳,发生的反应为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,然后过滤,得到的滤渣为Al(OH)3,煅烧滤渣,发生反应 2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
(4)偏铝酸钠和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,离子方程式为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,
故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(5)过滤时需要的玻璃仪器有漏斗、玻璃棒及烧杯,故答案为:漏斗、玻璃棒和烧杯;
(6)根据Al原子守恒得n(Al)=2n[Al2O3],所以m(Al)=$\frac{{m}_{2}g}{102g/mol}$=$\frac{27{m}_{2}}{51}$g,则Al元素质量分数=$\frac{\frac{27{m}_{2}}{51}g}{{m}_{1}g}$×100%=$\frac{{9{m_2}}}{{17{m_1}}}×100%$,
故答案为:$\frac{{9{m_2}}}{{17{m_1}}}×100%$;
[实验3]
(7)气体产物的平均摩尔质量=1.61g•L-1×22.4L/mol=36g/mol,氧气不足,生成气体是CO和CO2混合气体,
CO与CO2的物质的量之比为(44-36):(36-28)=1:1,
氧气的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,
设CO2为y mol,由氧原子守恒:y+2y=0.1×2,
解得x=$\frac{0.2}{3}$
故碳元素质量为($\frac{0.2}{3}$mol+$\frac{0.2}{3}$mol)×12g/mol=1.6g,
样品中碳元素的质量分数为$\frac{C元素质量}{样品质量}$=$\frac{1.6g}{10g}$×100%=16%,
故答案为:16%.
点评 本题考查物质制备、物质含量测定等知识点,为高频考点,涉及质量分数计算、基本实验操作、尾气处理、误差分析等知识点,明确实验原理、实验基本操作等知识点即可解答,难点是实验误差分析,题目难度中等.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | 水电离程度d<a<b<c | |
| B. | b点溶液的导电性比c点溶液的导电性弱 | |
| C. | a点KW的数值比c点KW的数值大 | |
| D. | b点酸的总浓度大于a点酸的总浓度 |
 常温下有下列四种溶液:
常温下有下列四种溶液:| 序号 | ① | ② | ③ | ④ |
| 溶液 | pH=4的NH4Cl溶液 | pH=4的盐酸 | 0.1mol•L-1的醋酸溶液 | 0.1mol•L-1的NaOH溶液 |
请回答下列问题:
(1)用④的标准液滴定③宜选用酚酞(填“石蕊”、“酚酞”或“四基橙”)作为指示剂,①和②两种溶液中由水电离出的c(H+)之比为106:1,
(2)都是0.1mol/L的①NH4Cl②NH4HCO3③CH3COONH4 ④NH4HSO4的溶液中NH4+离子浓度大小顺序为④>①>③>②.(用序号填空)
(3)取溶液③滴定20mL溶液④,滴定曲线如图所示,则a点时溶液中各离子浓度的大小关系为c(Na+)>c(OH-)>c(CH3COO-)>c(H+);若b点时消耗③的体积为V mL,则V>20(填“>”、“<”或“=”).
| A. |  溶解 | B. |  转移 | C. |  定容 | D. |  摇匀 |
| A. | 向Na2S溶液中加入少量的氯化银:S2-+2Ag+═Ag2S↓ | |
| B. | 向滴有酚酞的1 mol/L硅酸钠溶液中加入稀盐酸至溶液红色消失:SiO${\;}_{3}^{2-}$+2H+═H2SiO3(胶体) | |
| C. | 碳酸氢铵溶液中加入足量NaOH:HCO${\;}_{3}^{-}$+OH-═CO${\;}_{3}^{2-}$+H2O | |
| D. | 向苯酚钠溶液中通入一定量CO2: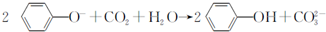 |
| A. | △H>0的反应一定不能自发进行 | |
| B. | 同温、同浓度的盐酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| C. | 为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 | |
| D. | 硫酸工业中二氧化硫的催化氧化生成三氧化硫,不采用高压是因为压强对SO2转化率无影响 |
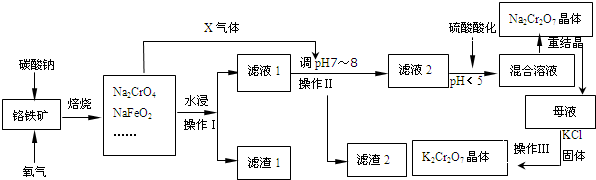
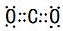 .
.