题目内容
下列关于卤素及其化合物的叙述正确的是( )
| A、HF水溶液可存放在玻璃试剂瓶中 |
| B、Br2可从KCl溶液中置换出氯 |
| C、F、Cl、Br、I的非金属性依次减弱 |
| D、HF、HCl、HBr、HI的稳定性依次增强 |
考点:卤素原子结构及其性质的比较
专题:卤族元素
分析:A.玻璃中含有二氧化硅,二氧化硅能溶于HF中;
B.氯气的氧化性大于溴,氧化性强的非金属单质能置换出氧化性较弱的非金属单质;
C.卤族元素中,元素非金属性随着原子序数增大而减弱;
D.非金属的非金属性越强,其氢化物越稳定.
B.氯气的氧化性大于溴,氧化性强的非金属单质能置换出氧化性较弱的非金属单质;
C.卤族元素中,元素非金属性随着原子序数增大而减弱;
D.非金属的非金属性越强,其氢化物越稳定.
解答:
解:A.玻璃中含有二氧化硅,二氧化硅能溶于HF中,反应方程式为4HF+SiO2=SiF4+2H2O,所以HF溶液不能盛放在玻璃瓶中,故A错误;
B.氯气的氧化性大于溴,所以氯气能置换出溴化钾溶液中的溴,溴不能置换出氯气,故B错误;
C.卤族元素中,元素非金属性随着原子序数增大而减弱,所以F、Cl、Br、I的非金属性依次减弱,故C正确;
D.非金属的非金属性越强,其氢化物越稳定,F、Cl、Br、I的非金属性依次减弱,所以HF、HCl、HBr、HI的稳定性依次减弱,故D错误;
故选C.
B.氯气的氧化性大于溴,所以氯气能置换出溴化钾溶液中的溴,溴不能置换出氯气,故B错误;
C.卤族元素中,元素非金属性随着原子序数增大而减弱,所以F、Cl、Br、I的非金属性依次减弱,故C正确;
D.非金属的非金属性越强,其氢化物越稳定,F、Cl、Br、I的非金属性依次减弱,所以HF、HCl、HBr、HI的稳定性依次减弱,故D错误;
故选C.
点评:以卤族元素、碱金属族元素为例熟练掌握同一主族元素性质递变规律,能从物质结构、原子结构知道其产生递变规律的原因,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述正确的是( )
| A、常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
| B、常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H<0 |
| C、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| D、常温下,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
短周期元素X、Y、Z、W在周期表中的位置关系如图所示,则下列叙述中错误的是( )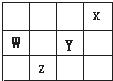

| A、四元素中,X的单质最稳定 |
| B、氢化物稳定性:HY>H2Z |
| C、原子半径:W>Y |
| D、W在周期表中的位置为:第2周期第5族 |
用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A、0.1mol/LAlCl3溶液中含有的Cl-数目为0.3NA |
| B、室温下,42.0g己烯和丙烯的混合气体中含有的碳原子数为3NA |
| C、标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA |
| D、100mL18.4mol/L硫酸与足量铜反应,生成SO2的分子数为0.92NA |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)
CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
| 催化剂 |
| A、增加压强 |
| B、升高温度 |
| C、增大H2O的浓度 |
| D、更换催化剂 |
设NA代表阿伏加德罗常数,下列叙述正确的是( )
| A、0.1 mol/L NaHCO3和0.1 mol/L Na2CO3混合溶液1L,HCO3-,CO32-的总数为0.2NA |
| B、向密闭容器中充入2molN2和3molH2,在一定条件下发生反应,达到平衡时,混合气体中NH3的体积分数为23.45%,则H2和NH3所含的H原子总数为6NA |
| C、若1L0.1 mol/L的CH3COOH溶液含CH3COO- 数为aNA,则1L0.3 mol/L的CH3COOH溶液含CH3COO- 数小于0.3aNA |
| D、反应N2+3H2?2NH3达平衡时,每形成6NA个N-H键,也生成14克N2 |
乙醇分子所含官能团的名称是( )
| A、乙氧基 | B、羟基 | C、乙基 | D、甲基 |
由乙烯和乙酸蒸气组成的混和气体中,若碳元素的质量百分含量为60%,则氧元素的质量百分含量为( )
| A、10% | B、20% |
| C、30% | D、无法确定 |